








































芳族磺酸类和碱熔融来制取酚类的經典方法,会生成碱金屬亚硫酸盐,而此盐的检定,就可作为芳族磺酸类一个试验法的基础。可是和碱熔融来产生碱金屬亚硫酸盐的,并不限于芳族磺酸类;脂族磺酸类,芳族磺酸及脂族磺酸的酰胺类也都会生成这个盐。碱类熔融各种过程中的反应如下:
RSO3H+3NaOH → RONa+Na2SO3+2H2O (1)
RSO3Na+2NaOH → RONa+Na2SO3+H2O (1a)
RSO2NH2+3NaOH → RONa+Na2SO3+H2O+NH3 (2)
(N-取代的磺酰胺类,不放出氨而放出胺类)
由此可見,和碱熔融来生成亚硫酸盐,乃是含有已被氧化了的四价硫及六价硫化合物的特性。如将这些化合物的溶度差别結合着和碱熔融一并予以考虑,就可能区别出这些化合物。例如,磺酸及其碱金属盐类可溶于水,而磺胺和砜类則不溶于水或酸类。按照反应式(2)和(4),磺胺与砜类不同之处,在其和碱熔融时,只有磺胺是会发出氨(或胺)的。(应注意到羧酸的酰胺类和碱熔融时,其性行和磺胺相似。)亚磺酸类是可用氯化鉄从其无机酸溶液中的沉淀性来辨认的。这个反应虽不甚灵敏,但可用来区别亚磺酸类和磺酸类。
用酸类从碱金属亚硫酸盐释出二氧化硫的检定方法,都适用于显示四价硫或六价硫有机化合物用碱熔融法所产生的亚硫酸盐。特别好的试驗法,是令绿色的氫氧化鎳Ⅱ和二氧化硫接触来形成黑色的水合氧化鎳Ⅳ。这反应涉及二氧化硫的自动氧化,以引起Ni(OH)2轉变成NiO(OH)2,而这个变化常仅是在通过强氧化剂时才能发生的。二氧化硫和Ni(OH)2接触时,也許先产生碱性亚硫酸盐,然后其阳离子及阴离子組份再放大气中的氧所氧化;这种氧化常和二氧化硫的氧化一起发生,或受其誘导而起:
2Ni(OH)2+SO2 → (NiOH)2SO3+H2O
(NiOH)2SO3+O2 → NiO(OH)2+NiSO4
NiO(OH)2的产生,很容易从绿色的Ni(OH)2变为黑或灰色辨认出来。痕量的NiO(OH)2可用联苯胺滴試作出檢定,那时有藍色(联苯胺藍)出現。
应注意到,含二价硫的有机化合物(如硫酚类、硫醇类、硫醚类、二硫化物类、硫酮类)和碱熔融时,会产生碱金屬硫化物,在酸化时再产生硫化氫,能使绿色的氫氧化鎳轉变为黑色的硫化鎳。可能把硫化鎳誤认作黑色的NiO(OH)2。所以最好先做一次初步碱熔融試驗;让熔质冷却后加酸,用醋酸铅試紙檢試气体中有无H2S。若試紙不变黑色或棕色,下面的操作手续即是試驗有机化合物中被氧化的硫的可靠方法。硫化鉛試驗如果得出正反应,可将試样(硫酚、硫醇、硫酮类)的水溶液,或将其和碳酸铅所成的悬浮液,加热去硫。将PbS-PbCO3混合物的滤液或离心液蒸发,然后用干的蒸发殘渣来試驗其已氧化的硫。
操作手续 用一球部的容量約为3毫升硬玻璃管。固体試样少許或其溶液一滴的蒸发残渣和氧化钠一粒,在小火焰上加热,至混合物刚熔化时为止。冷却后,将熔体溶在2滴水中,加入浓盐酸1或2滴(酸反应經石蕊紙试验过),管壁用水洗滌。管口仔細擦干后,将一条带着绿色Ni(OH)2的滤紙悬在管口上,然后将球部插入热水中数分钟,以催促二氧化硫的发出。如果绿色变为黑色或灰色,即証明亚硫酸盐的存在。待检定的物量很少时,最好用联苯胺的醋酸溶液来滴試氢氧化镍;即使有痕量的NiO(OH)2存在,亦会形成蓝色。
试剂:1)氫氧化镍試紙。
2)联苯胺或联苯胺盐酸盐0.05克溶于10毫升2N醋酸中,用水稀释至100毫升后滤清。
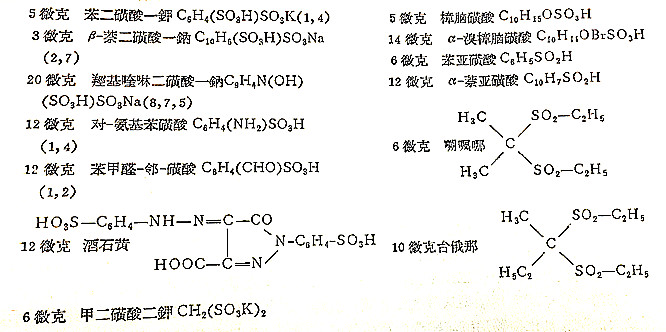
这个操作手续可检出: