甲烷 羟基化酶的晶体结构
化学先生 / 2019-07-30
为详细了解甲烷单加氧酶的空间结构信息,1993年,Lippard领导的科研小组首先在Nature上报道了M.capsulatusBath菌的羟基化酶晶体结构,在学术界引起极大兴趣。
羟基化酶经过纯化以后,他们对缓冲液、盐浓度沉淀剂、温度、pH、蛋白质浓度等结晶参数进行了1000 多次筛选,首次用真空扩散法获得了Bath菌的MMOH晶体,并进行了X光单晶街射分析。
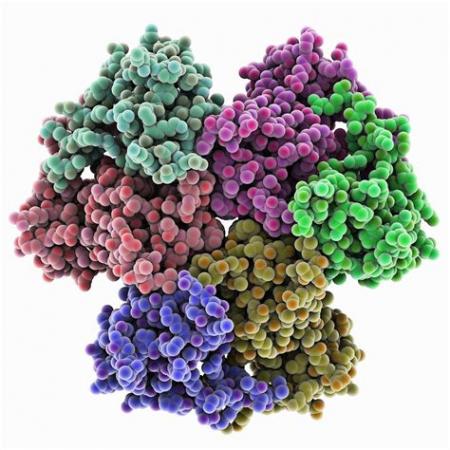
发现,该晶体呈斜方型(6nmX 10nmX 12nm),两个单体以非晶体学对称轴折叠,在分子中心有一个“谷”沿着两个单体的界面展开,三个亚基组成以a螺旋为主,a亚基有2个城,一个是由6个长的a螺旋(ABCEFG)和6个短的a螺旋组成;另一个城有7个小a螺旋,2个β发夹式折叠组成; β亚基由12个a螺旋组成,其中6个a螺旋是由25个以上的氨基酸残基组成: Y亚基位于a、β亚基交界面的最外面,由8个a螺旋组成。
a、β亚基相互作用并缠绕在一起,MMOH的单体构成了“心”的形状,两个二聚体相毗邻形成大于两倍单体体积的分子。1994 年,Lipscomb 领导的研究组报道了OB3b菌羟基化酶的晶体构象,该晶体也呈斜方型(26. 45nmX7.12nmX 13.94nm),有一半的MMOH量不对称性。
Elango则测定了其晶体结构和部分氨基酸序列,表明其双核铁活性中心Fe-Fe的距离为0. 299nm,双核铁活性中心的结构与Bath菌羟基化酶基本相同,说明不同菌种来源的MMOH基本具有共同的结构特征,
MMOH的双核铁活性中心位于a亚基,这与其它类似实验结果一致,每个MMOH分子中含有4个Fe原子。尽管Dewit11]的实验曾指出,每分子MMOH中只有2个Fe原子,很可能是由于纯化过程中,造成一部分Fe丢失而引起的试验误差。
每个MMOH蛋白分子中含有4个铁原子的实验事实,支持了每个MMO分子中包含2个类似的双铁核活性中心的假设,修正了Atta等的旱期实验报道,他们曾认为每个MMO分子只含有一个活性中心。
在来源于Bath菌的sMMOH中,两个活性中心的距离为4. 5nm,双核铁原子位于a螺旋E和F之中。大多数双核铁活性中心的配位环境和几何构型有很好的一致性,通过X光单晶行射分析,FeFe的距离为0.34nm,与EXAFS谱结果基本致(O. 342nm)。
双核铁由两个非蛋白配位桥连接, 每个双铁核中心由4个谷氨酸、2个组氨酸、1个水分子配位,星八面体构型。自然状态下双核铁原子呈现氧化状态,不论用EXAFS、ENDOR,还是EPR、Mossbauer谱表征,所显示的双核铁中心配位环境都基本-致。
这两个双核铁中心的构型是完全相似的,都显示出不对称性。双核铁中心有一个疏水腔,铁原子和它的配基定位在这个腔的内表面上,这一环境可能为底物氧化提供了合适的场所。在这里,O2分子被活化,将一个氧原子插入到甲烷分子中形成甲醇。尽管结构研究并没有直接提供反应机理的信息,但它为反应机理的研究提供了二些可参考的线索,双核铁中心水和乙酸盐配基的位置很可能就是还原态铁原子与O2的结合处。










































![3-[N-三(羟甲基)甲胺]-2-羟基丙磺酸C7H17NO7S](images/202408/thumb_img/5590_thumb_G_1722841877162.jpg)