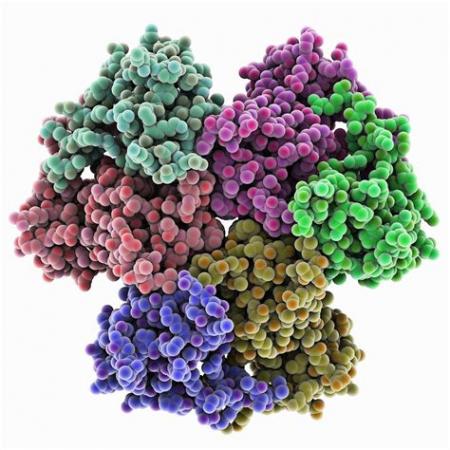
甲烷单加氧酶的总体构型
化学先生 / 2019-07-29
甲烷单加氧酶( methane monooxygenases, EC1.14. 13.25)的分子量约301kDa,研究比较深入的是可溶性甲烷单加氧酶sMMO,它包含三个组分:羟基化酶(sMMOH, 220~ 250kDa)、还原酶(sMMOR, 38~ 41kDa)和调节蛋白B (sMMOB, 15~ 18kDa). sMMOH是由三个亚基组成的二聚体(aβr)2,每个单体有一个双核铁活性中心,位于羟基化酶的a亚基上,a亚基既含有a螺旋也含有β折叠,也是sMMO中唯一存在β折叠的亚基,活性中心的Fe原子被a螺旋束所包围,a螺旋束结构延伸到双核铁中心的非极性腔中,通过研究核内极性或非极性区域所处的位置,可以预测甲烷进人活性中心的通道和电子转移过程。β亚基、Y亚基均由a螺旋组成,从它们可以观察亚基之间疏水、亲水部分的相互作用。
活性中心呈现疏水性,对酶与小分子底物的相互作用至关重要。通过了解a螺旋束如何保持MMOH的构型,可进一步理解MMOB、MMOR与MMOH的结合位点,以及在活性中心上烷烃、烯烃如何被氧化。一般情况下,双核铁活性中心由4个谷氨酸、2个组氨酸、1个水分子配位,两个铁原子间由一个羟基氧桥或羰基桥(p-OH 或p-Oxo)连接,自然状态下双核铁以氧化态形式存在,活性中心的Fe与6个配基结合,形成一个“钻石”核结构,如图3-2所示。
sMMO的羟基化酶与其它蛋白,如蚯蚓血红蛋白、核酸磷酸酯酶具有相同的p-羟基氧桥双核铁活性中心,但其催化性能不同,这可能是由μ~羟基氧桥双铁核活性中心的配位不同所决定的。还原酶(sMMOR)由2个城组成,一个是含有FAD( flavin adenine dinucle-otide,核黄素腺嘌呤二核苷酸)和NADH(烟酰胺腺嘌呤二核苷酸)的结合部位城(MMOR-FAD),分子量为27.6kDa,由250(99~348)个氨基酸组成;另一个是含有[2Fe-2S] 的铁氧化还原蛋白城(MMOR-Fd),由98(1~ 98)个氨基酸组成。调节蛋白B是一个分子量为16kDa的小分子蛋白,整个蛋白质表面呈现疏水性,在酶催化反应过程中起着调节作用,见图3-2。
对于任何一个蛋白质结构的确定和模拟都要清楚了解它的四级结构,而长期以来对颗粒性甲烷单加氧酶(pMMO)的亚基结构一直难以确定。1989 年,Smith和Dalton[1]首先获得了由Bath菌部分纯化出的pMMO,他们使用十二烷基β麦芽从该微生物的细胞膜上溶解出活性组分。发现pMMO也含有3个亚基,pMMA/pMMB/pMMC.来自于Bath菌的pMMO的活性中心约有2个Fe和15个Cu,形成了生核铜的活性中心结构,活性中心位于pMMA上,也有可能位于pMMB上。
Takeguchi[2] 纯化了OB3b的pMMO,测定出pM-24MO总分子量为326kDa,由2个亚基组成,分子量分别为25kDa和41kDa, 另外还有一个26kDa的蛋白存在,但未说明它的四级结构。Lieberman[3) 的研究则认为,来自Bath菌的pMMO的总分子量为200kDa,由3个亚基组成,是个二聚体,这与Yu的工作很相似,但同时他们也观察到有一个分子量为440kDa的四聚物存在。
2005 年,Lieberman 在Nature上发表了来自Bath菌的pMMO的晶体结构,该晶体呈现高为10. 5nm、直径是9nm的圆柱体型,是一个三聚体,很遗憾这个实验没有给出酶的活性和其它性质。同年,Kit-mitto[6]对有活性的Bath菌的pMMO进行了三维结构测定,也确认它是一个三聚体,单体由47kDa、26kDa 和23kDa的三个亚基组成。
综合其它报道总的来看,来自于Bath菌的pMMO活性中心趋向于含Fe/Cu原子,来自于OB3b的pMMO活性中心趋向于只含Cu原子。在细胞外,四甲基对苯醌和NADH2能够作为pMMO的电子给体,使pMMO能够氧化1~5个碳原子的烷烃和烯烃,但不能氧化芳香烃化合物。

























.jpg)
