













































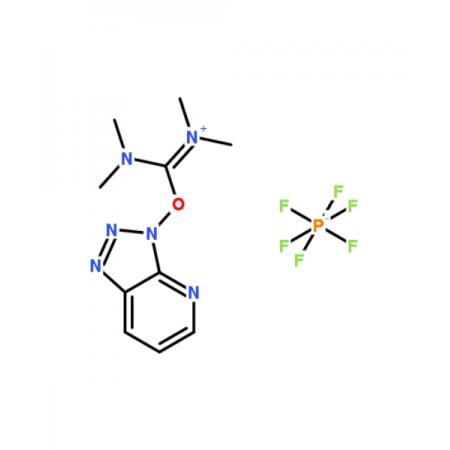
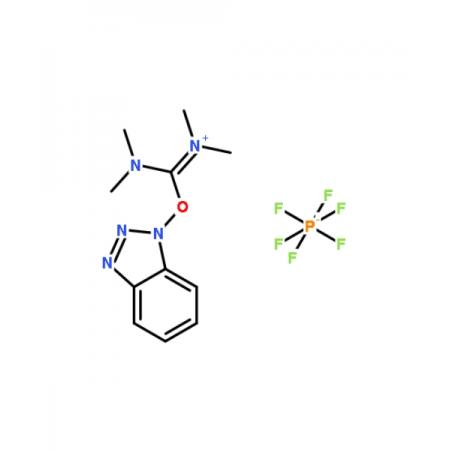


焦磷酸是无色玻璃状固体,易溶于水,在冷水中会慢慢地转变为正磷酸。焦磷酸水溶液的酸性强于正磷酸,它是一个四元酸(291K,K1>1.4×10(-1次方)、K2=3.2×10(-2次方)、K3=1.7×10(-6次方)、K4=6.0×10(-9次方)),能生成三种盐:二代、三代和四代。常见的焦磷酸盐有M2H2P2O7和M4P2O7两种类型。将磷酸氢二钠加热可得到Na4P2O7:
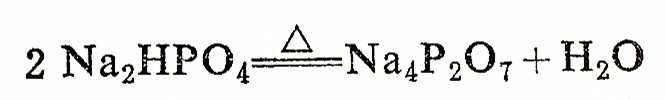
在分别往Cu2+、Ag+、Zn2+、Hg2+等离子溶液中,加入Na4P2O7溶液均有沉淀生成,但由于这些金属离子能与过量的P2O74-离子形成配离子如[Cu(P2O7)]2-、[Mn2(P2O7)2]4-,当Na4P2O7溶液过量时,沉淀便溶解。
常见的偏磷酸有三偏磷酸和四偏磷酸。偏磷酸是硬而逶明的玻璃状物质,易溶于水,在溶液中逐渐转变为正磷酸。将磷酸二氢钠加热,在673~773K间可得到三聚偏磷酸盐:

把磷酸二氢钠加热到973K,然后骤然冷却则得到直链多磷酸盐的玻璃体即所谓的格氏盐
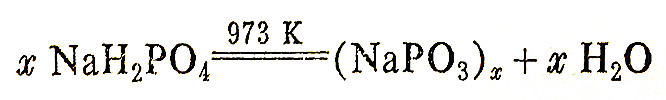
它易溶于水,能与钙、镁等离子发生配位反应,常用作软水剂和锅炉、管道的去垢剂。过去曾把格氏盐看成是具有(NaPO3)6的组成,因而被称为六偏磷酸钠;实际上格氏盐并不存在(PO3)66-这样一个独立单位,而是一个长链的聚合物。这个链长约达20-100个PO3-单位。

正磷酸、焦磷酸和偏磷酸可以用硝酸银加以鉴别。正磷酸与硝酸银产生黄色沉淀,焦磷酸和偏磷酸都产生白色沉淀,但偏磷酸能使蛋白沉淀。

P4O6与水反应或PCl3、PBr3、PI3等的水解都能生成亚磷酸。
纯的亚磷酸是无色固体,熔点346K,易溶于水。亚磷酸是一个二元弱酸,它分子中有一个与P原子直接共用电子的氢原子,它不能被取代。它的电离常数,K1=1.0×10(-2次方),K2=2.6×10(-7次方)。纯亚磷酸或它的浓溶液被强热时,发生歧化反应。
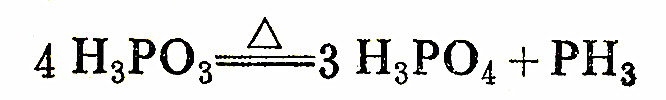
亚磷酸和亚磷酸盐在水溶液中都是强还原剂。
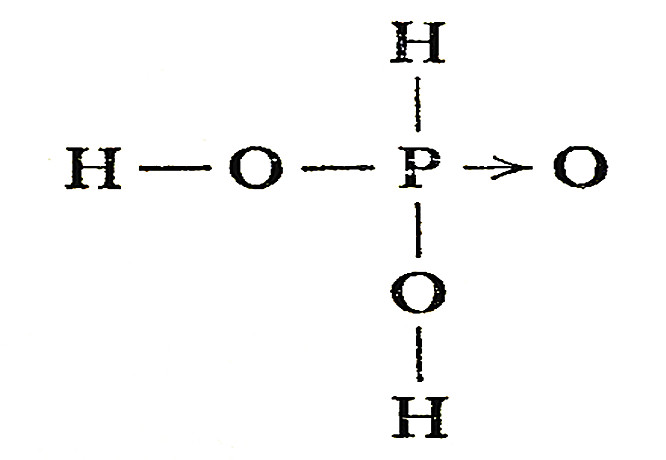
在次磷酸钡溶液中,加硫酸使钡离子沉淀,便可得游离状态的次磷酸。
Ba(H2PO2)2+H2SO4=BaSO4↓+2H3PO2
次磷酸是一个中强一元酸,它的分子中有两个与P原子直接键合的氢原子。
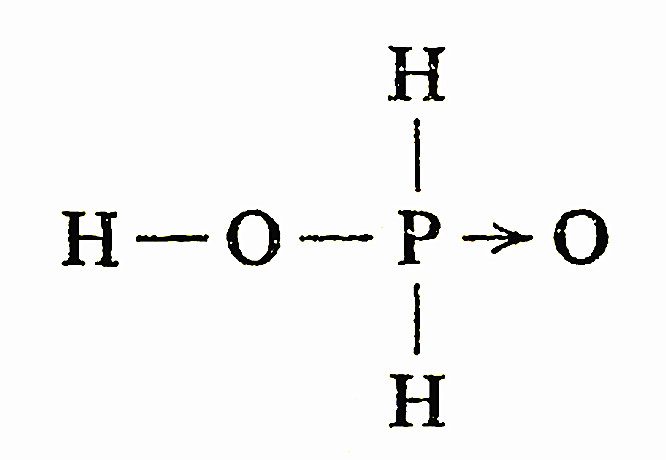
在298K时的Ka=1.0×10(-2次方)。次磷酸及其盐都是强还原剂。