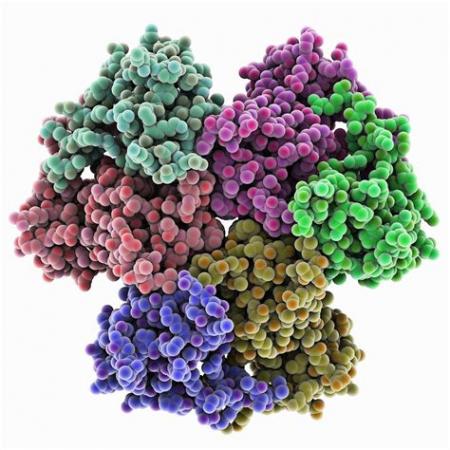
甲烷单加氧酶调节蛋白MMOB的结构
化学先生 / 2019-07-30
调节蛋白B的分子量大约是16kDa,由7条β链构成两个β带,这2个β 带成直角,通过3个a螺旋,互相垂直交联在一起,邻接部分呈现螺旋趋势,但较混乱。N端易受蛋白影响发生水解,N端水解后缩短了MMOB的链长度。基因重组的MMOB与天然MMOB相比,和MMOH结合的亲和性有所降低。甲烷羟基化反应的效率,取决于MMOH和MMOB在催化过程中的相互作用动力学。整个蛋白质表面呈现疏水性,在酶系统反应中只对MMOH一些关键部位的结构和功能起调节作用,没有直接参与酶的催化反应。Walters等[42]利用NMR谱,研究了Bath菌的MMOB高精度精细结构谱,并观察了在MMOR存在或缺少情况下,MMOB与MMOH的结合情况。
Chang等采用'H、PC、I5N标记的RNA异核糖核酸(heteronuclear)的2维、3维NMR谱,研究了含138个氨基酸的重组MMOB(OB3b)溶液结构,通过脉冲场梯度NMR自扩散( pulse field gradient NMR self- diffusion)测定表明,MMOB的蛋白浓度在1mmol/L时主要以二聚体的形式存在,在低于0. 2mmol/L时主要以单体形式存在。分子折叠较好的部分氨基酸残基为36~126片段,与类似蛋白相比较,来自于OB3b的MMOB是一个更紧密的蛋白质,缺乏更大的环状空穴。
调节蛋白B是一个单体,在2个较弱的位点与MMOH结合,在低浓度时,MMOB可使MMOH从一个氧化酶转化为羟基化酶],当MMOB的浓度使2个结合位点达到饱和时,MMOH的活性被削弱。由于MMOH的两个双核铁中心处于由a、β亚基形成的谷底,相距1. 2nm, MMOR与MMOH的结合点可能在“谷”中,而MMOB则有可能结合在较深的谷下。后来经过光谱、化学交联、稳态动力学、恒温热力学等研究,实验结果支持这一假设。利用高分辨率的NMR探索MMOB分子表面的残基、MMOB与MMOH的结合点以及MMOR对MMOH和MMOB结合的影响表明,约有10~12个氨基酸残基隐藏在MMOB表面背后,很可能是它们在与MMOH结合中起主要作用。MMOB的分子表面有很多疏水残基,使得MMOB与MMOH易于发生相互作用,MMOB的亲和性随着盐浓度的增加而增加也同样说明了这一点。由此推断,MMOB与MMOH的结合,可能是由MMOB疏水表面与MMOH的a、β亚基对,形成的疏水腔相互作用的结果。在没有MMOH存在下,NMR的研究表明,MMOB与MMOR并不发生相互作用,加人MMOH后,与MMOH的结合中也不相互竞争。总之,MMOB构成了复杂的、不寻常的折叠,在相互作用中没有直接与还原酶相互作用,而是与MMOH结合后,通过诱导变形发挥调节作用。在没有MMOB存在的情况下,MMOH与MMOR也能催化底物反应,但反应速率很低。MMOB一向被认为是通过形成特殊通道或增加某一区域部分结构的灵活性,来控制底物进人到MMOH活性中心,实现底物、O2的转化。Wallar 等[45]对MMOB残基末端的四个氨基酸(N107G/S109A/S110A/T111A) 进行四倍突变发现,大大加速了甲烷与中间体Q的反应速率。Brazeau 等[46]采用单倍、双倍的MMOB基因突变研究显示,突变后的MMOB在许多方面改变了MMOH的催化反应性能,但与四倍基因突变情况有所不同。对比后认为,MMOB氨基酸残基有可能构成MMOB-MMOH复合物分界面的一部分,使底物更容易接近MMOH活性中心。特别是Thri的突变对催化反应影响最大,由于Thr11的突变,甲烷与中间体Q的反应速率常数降低,增大了乙烷、呋喃、硝基苯与中间体Q的反应速率常数。Thr11突变型MMOB与天然酶相比,使反应循环中的其它步骤减慢了十几倍,硝基苯氧化的区域特征也发生了变化。因此认为,MMOB中的Thr1i是控制底物进人MMOH活性中心的关键组分,起着一个开关“阀”的作用。
为了进一步研究MMOH与MMOB的结合部位,MacArthur等采用SREPR (saturation-recovery EPR)谱研究了氧化态MMOH的双铁核中心,证明MMOB的结合改变了Fe2的交换对,结合这个结果与Fe2和Cys89之间的距离测定结果,可以推断MMOB是直接结合到Fe2配基的a螺旋体上,引起了活性中心几何构型的改变。MMOB对氧化态MMOH有影响,这与前面观察到的只对半还原态MMOH有影响不同,但没有其它谱学方法证明这一点。只与氧化还原电势的研究结果相一致。这意味着还原过程或与MMOB结合过程都伴随着结构的变化。



























![2,2-(2,5-二苯基硫代)双[5-(1,1-二甲基乙基)]苯并恶唑](images/202408/thumb_img/5626_thumb_G_1724984933821.jpg)