过氧化钠与水或稀酸在低温时作用,生成过氧化管:
Na₂O₂+2H₂O= H₂O₂+ 2NaOH
Na₂O₂+H₂SO₄=H₂O₂+Na₂SO₄
所生成的过氧化氫在常温下立即分解为氧,故过氧化筑广泛地用做氧气发生剂和漂白剂。
过氧化鈉在潮湿空气中能吸收CO₂并放出氧:
2Na₂O₂+2CO₂= 2Na₂CO₃+O₂
因此,它常用作高空飞行或潜水时的供氧剂。它的热稳定性高,熔化时并不分解,与不溶于酸的-些矿 石共熔可使矿石分解。
(iii)超氧化物(MO₂)超氧化鋰 的制备是将水合过氧化鋰Li₂O₂·2H₂O在100—129°时其空干燥,得含有9% LiO₂的固体。純超氧化鋰佝未制得。在10大气压和400 —500°,鈉与氧直接化合而生成NaO₂。鉀在过量空气中燃燒即得超氧化鉀,KO₂将金屬銣或銫溶于液氨中,通入純净干燥的氧,所得到的RbO₂或CsO₂純度可达98%。超氧化物与水反应立即产生氧和过氧化氧:
2MO₂+ 2H₂O= O₂+2MOH+H₂O₂
較易制备的KO₂常用于急救器中。
3.氢氧化物
工业制备碱金屬氨氧化物的旧法是利用碳酸盐和氢氧化鈣的复分解作用:
M₂CO₃+Ca(OH)₂ =2MOH +CaCO₃↓
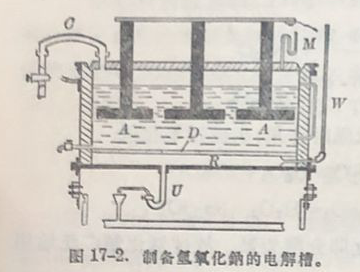
现代方法是电解金属氧化物面得氢氧化物。这里以NaOHI的制遭为例,介招一种通用的电解方法。
电解槽的装置示意于图17-2。D为石棉隔膜。石墨A作为阳极;铁赫网与隔膜的下面接触,作为阴极。这样,所膜就把两电极隔开。自M处不断注入食盐水。为了防止食盐水透过石棉隔膜太快,在隔膜的上面金以硫酸织。当电流通过食盐水时,在阳极上放出氯,在阴极上放出氩。
阳极上: 2Cl⁻=Cl₂+2e
阴极上: 2H⁺+2e =H₂
在阴极附近,氫氧化鈉随着电解的进行而积集。含有NaOH的盐水超过空同R,不断自U处流出。氯气自C逸出;氩气自W逸出。
将含有NaCl和NaOH的混合溶液蒸发,首先析出的是NaCl,剩下的母液合氩氧化纳。将母液再行蒸发,即得固体氢氧化鈉。
表17-4列出碱金屬氢氧化物的若干性质。碱金屬氨氧化物是无色固体,且易熔(在300—400℃)。 除LiOH在100℃左右即分解为氧化物外,其余氫氧化物在赤热时只揮发而不分解。熔融的氢氧化物对于玻璃、陶壳和鉑有强的腐触性,因此在熔融固体或蒸发碱液时,不可使用这类器皿,而须使用銀、鎳或铁皿。盛碱液的瓶子应盖以木塞或橡皮塞。
表17-4 碱金属氢氧化物的性质
| 性质 |
LiOH |
NaOH |
KOH |
RbOH |
CsOH |
|
密度
熔点,°C
生成热(从H₂O),千卡/克分子
溶解热,千卡/克分子
在水中的溶解度,克分子/升,15°C
|
2.5
450
11.2
4.8
5.3
|
2.1
328
18.0
10.4
26.4
|
2.0
360
21.7
13.2
19.1
|
3.2
300
25.7
14.7
17.9
|
3.7
275
25.0
16.8
25.8
|
碱金局氫氧化物皆溶于水和乙醇中。在溶解于水时釋出大量热来(表17-4)。在水溶液中它們完全电离,因此是最强的碱。LiOH比其它氫氧化物的吸水性差,但可从溶液中析出一水合物LiOH·H₂O。其它碱金属氫氧化物也形成水合物。
碱金屬氩氧化物很容易与空气中的CO₂作用,生成碳酸盐:
2MOH +CO₂=Mg₂CO₃+H₂O
气体中CO₂含量的测定就是利用这种作用。也由于这种作用,碱金属氫氧化物中常含有碳酸盐。如欲配制不含碳酸盐的氨氧化鈉溶液,可先制备极濃的NaOH溶液。在这种溶液中碳酸盐不溶,故靜置后即沉淀,上面的清液就是純NaOH溶液。