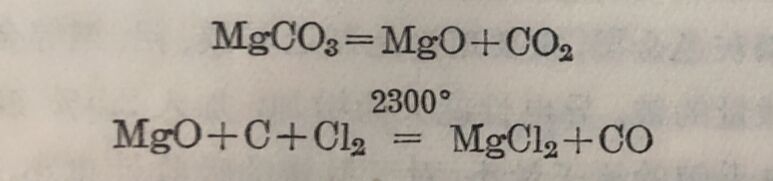(2)在已秘过滤的海水中加入熟石灰,氩氧化鎂自海水中析出,过滤后,用盐酸溶解,将溶液蒸发,即得MgCl₂·6H₂O晶体。最后使MgCl₂·6H₂O在氯化氢气流中脱水。将无水氯化鎂混以适量的氯化鈉,置于电解槽中进行电解,在电极上得金屬鎂。近来有朵用热还原法来制造金属鎂的,这法是用碳化鈣或硅来还原氧化鎂,反应为
MgO+CaC₂=Mg+CaO+2C
2MgO+2CaO+Si(Fe)=Ca₂SiO₄+2Mg
鈣,鍶和鋇都可由氯化物的电解制得,不过鋇和鍶的冶炼要困难些,因为它們在电解质中容易分散为胶态。
自矿石中提取鈹的方法是先将綠柱石和石灰共熔,矿石按下式分解:
3BeO·Al₂O₃·6SiO₂+6CaO=3BeO·Al₂O₃+ 6CaSiO₃
用硫酸处理结块,鈹和鋁变为硫酸盐,用水溶解,然后加入硫酸銨使銨鋁矾(NH₄)Al(SO₄)₂·12H₂O自溶液析出。将母液蒸发,可得 BeSO₄·4H₂O晶体。在1000-1100°C 間焙燒,硫酸盐分解为BeO:
BeSO₄·4H₂O=BeO+SO₃+4H₂O
BeO在600°C以下羥氯化生成BeCl₂:
BeO+C+Cl₂=BeCl₂+CO
电解BeCl₂,得金屬鈹。
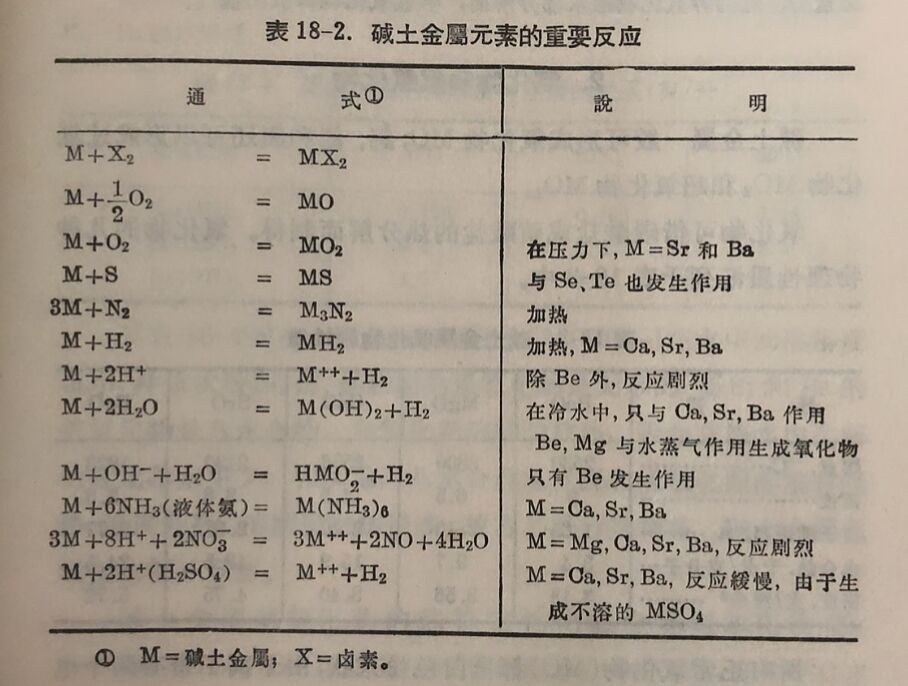
二、碱土金屬的性质和用途
鈹最初是从綠柱石分离出来而被发現。它原来的外文名字有糖的意义,因为它的若千化合物有甜味。但它所有的化合物皆很毒。鈹是鋼灰色金屬,重要用途是制造与鎂、鋁、銅等金属的合金。銅里加入微量的鈹,导电性就大为增加;加入2.5%鈹,硬度即墙加六倍。由于鈹的原子量小,对X射线的吸收性也小,所以用于制造X射钱管的窗玻璃。鈹的另一个重要用途是作为原子反应堆中的减速剂,因为它只减慢热中子的速度而不加以俘获。
鎂是很輕的金屬,容易燃燒而形成很稳定的氧化物,MgO。冷水和它作用很慢,但若在水中加大少許氯化銨幷略加热,鎂即迅速溶解而放出氢。鎂在水中作用慢是因为在它表面上生成一层氢氧化物的保护膜,加入氯化銨后,保护膜破坏,故反应加速。它在稀 酸内溶解得很快,它可在很多种气体中燃燒,与 氮形成氮化物, Mg₃N₂。在高温时, 它可从若干气体化合物中摄取氧,例如,与二氧化碳形成氧化鎂而釋出碳:
2Mg+CO₂=2MgO+C
但鎂有抗碱的作用。它和硼、硅、磷、砷这类非金屬元素的化合物常用于制备这些元素的氢化物。金屬鎂用来制造焰火、閃光粉;用作治金中的还原剂和去氧剂。但艳大部分的金属鎂是用于生产輕合金以供制造飞机之用。
鈣比鎂还輕,燃燒时发生磚紅色火焰而形成氧化物。在冷水中溶解慢,在热水中溶解很快,并生成稍溶的氢氧化物和氢。它与酸反应剧烈。凡与鎂化合的非金属,也与钙化合,但鈣还可以直接与氧化合,而鎂則不能。在工业中钙的用处不多,只在制造若干合金时用作去氧剂和还原剂。在治金工业中,它用作铁的去氧和去硫剂,鉛的去鉍剂,等等。
鍶的性质与钙相似,但它的重要性則不及,因为鍶金屬和它的化合物用途很少。
鋇金屬与鈣、鍶,除晶型不同外,其他性质皆相似。它和它的可溶性化合物皆有毒。鋇金属也沒有重要用途。