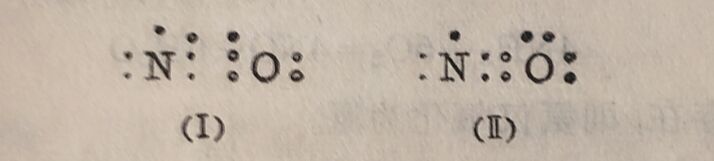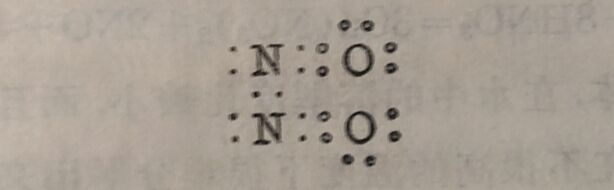見,在1500°左右,氧化氮合成反应的平衡仍然是几乎完全移向方程式的左边,而且平衡的建立非常慢,約需30小时。在較高的溫度时,不仅生成較多的NO,并且达到平衡状态所需时間要快得多。因此,在打雷的时候大气中常有NO产生。在工业上是将混合气体通过电弧,使在4000°左右达到平衡,然后极迅速地加以冷却,以防止混合物内NO含量的降低。
現在所用的較好的方法是在500°以上,以鉑作接触剂使氨氧化,其反应为
4NH₃+5O₂=4NO+6H₂O
若无接触剂存在,則氨仅氧化为氮。
虽然氧化氦是一个强烈的吸热化合物,但在平常条件下,它是稳定的。在实驗室内,氧化氮通常是用不很濃的硝酸与銅作用而制得,其反应为
3Cu+8HNO₃=3Cu(NO₃)₂+2NO+4H₂O
氧化氦是无色气体,在水中的溶解度比較小,而且与水不起化学变化。它所含的氧在不很高的温度下很难分解出来,因此,它不助燃。但在高温时,它就有氧化作用,例如磷、鎂等在其中能燃燒。在常溫时,它与氧化剂可发生作用,如高錳酸、次氯酸等可将它氧化为硝酸;氧与它化合为二氧化氮;卤素和它化合为亚硝酰卤素:
3MnO₄⁻+5NO+4H⁺→3Mn⁺⁺+5NO₃⁻+2H₂O
2NO+O₂=2NO₂
2NO+Cl₂=2NOCI
它还可以作为一个中性粗分与許多金屬盐秸合。例如,它与FeSO₄在溶液内形成深棕色的硫酸亚硝基铁", [Fe(NO)]SO₄。加热时,NO即自溶液内完全逸出。溶解于浪硫酸的硫酸銅也与NO形成这种不稳定的亚硝基化物。这类組成簡单的亚硝基化合物只存在于溶液中。若干較复杂的化合物則較为稳定,例如五氰亚硝基貉铁"酸鈉Na₂[Fe(CN)₅NO]是一种稳定的暗紅色秸晶的盐。
氧化氮分子内的电子数为奇数。这类奇电子化合物,为数不多,而氧化氮的性质与其他奇电子化合物有所不同。一般奇电子分子皆有色,但氧化氮在气态时为无色,虽然它在液态和固态时显藍色。它在气态时也不显聚合作用;在液态和固态时有双聚分子(NO)₂存在。这些特性和它的化学性质皆表明氧化氦的結构特殊。它的电子构型可能有两种:
式(I)表示氮原子和氧原子是以三个键相连接,其中一个为三电子键。在氧化氮聚合为双聚分子时,这种三电子键即拆开成为如式(I)构型的分子,从而产生双聚分子:






![1,8-二氮杂二环[5.4.0]十一碳-7-烯](images/201812/thumb_img/1103_thumb_G_1545291985569.jpg)







































![1,5-二氮杂双环[4.3.0]壬-5-烯 DBN](images/202306/thumb_img/5107_thumb_G_1688093666688.jpg)