红外吸收光谱
化学试剂,九料化工商城 / 2020-12-05
目前,有机化合物的鉴定和结构式的测定,物理方法的应用已远远超出了化学方法,后者只作为前者的补充工具.而在物理方法中,则以红外吸收光谱,紫外吸收光谱,核磁共振谱及质谱应用最广.其中红外吸收光谱,由于能对各种官能团给出特征吸收带,而且由于仪器已经发展到小型化和操作简便化,因此在有机实验室中,应用更为广泛.
一、分子的跃迁类型与吸收电磁波范围的关系
分子的运动,除了平移运动以外,其它运动形式,如转动,分子内部原子或基团的振动,电子运动等,都是量子化的、只有吸收了与某一运动方式的能阶变化能量相符的电磁波,オ能使相应的运动方式的能阶提高表8.8.1表示了电磁波的范围与分子运动跃迁的关系,表中波长以厘米,微米和毫微米表示,率用“波数”ν-表示,即1厘米长度内所含的电磁波数,它与频率的关系为ν-=ν/C,其中ν为电磁波的频率,C为光速,每秒310厘米,故的单位为厘米-1.
二、基本原理
一个由π个原子组成的化合物,有3π个运动数,每一个运动称为一个自由度,因此就具有3n个自由度、其中三个自由度属于分子在三度空间内三个方向的平移运动,另外二个(线型分子)或三个自由度属于整个分子在空间坐标轴上的二个或三个转动运动其余的自由度都属于分子内部的由价键连接的二个原子或基团之间的振动运动因此一个分子所含的原子愈多,则振动自由度也愈多一个分子的振动自由度为3π-5(线型分子)或3π-6.
分子的平移运动能量的变化,可以认为是连续的,随温度的变化而变化.转动能量的变化,则是量子化的即是按照阶0,1,2,3……吸收一定量的能量后提高的、如果一个分子具有偶极矩,则能吸收相当于相邻二个能阶能量之若的光子,而提高其能阶分子的转动运动的能阶之差是很小的,其数量级相当于0.001-1千卡/克分子,所吸收的相应电磁波长范围为30-10000微米之间.測定分子的转动吸收谱,可以准确地测得分子内原子之间价键的长度和键间的夹角.但这一方法只能用于气体,而且仪器也很复杂,所以应用不广.
至于分子内各个价键所连原子之间的振动,便是本节内所要讨论的重点分子内任何二个由价键连结的二个原子,可看作二个质量不等的球,而价键则看作将这二个球连起来的弹簧;这样便构成了一个谐振子,其频率可按下式算出:
1 m1 m2
ν=----√Κ/(------------)
2π m1+m2
在上式中,ν为振动频率,m1和m2即为由相应价键连接的二个原子的各自原子量.mm/m+m称为折合质量( reduced mass).h为力常数,与构成化学键的键能有关,键能愈高值也愈高.从上式中可以看到,由价键所连接的二个原子,如键能愈高,由于Κ的数值高而振动频率高.反之如折合质量愈高,则振动频率愈低,这个概念对我们以后了解基团的特征吸收频率很有用处.
我们虽将分子中的各种原子之间的振动作为一个谐振子,但与经典的谐振子不同之处,是它的振动能的变化是量子化的只能吸收一定能量的光子,能提高一个或几个能阶原子间振动能阶是整数的,即0,1,2,3,…….一般说来,在室温及稍高温度时,分子中的各个振动能阶均处于0级,当一些由价键相连的原子或基团具有偶极矩或在能阶政变后出现偶极矩时,都能吸收特定波长的电磁波而提高其能阶,最普遍的是由0级提高到1级.但对完全对称的键如乙烯及其四个替代基相同的生物,由于本身无偶极矩和提高能阶后也不出现偶极矩,因此C就不能吸收光子而须用喇曼效应测定;对乙炔及其二个替代基团相同的行生物也同样不出现C≡C吸收.提高振动能阶吸收的电磁波的频率需与振动频率相等,因此振动能阶提高的能量△E即等于吸收的光子
hν,其波长范在2.5-25微米之间,属于红外光。
对于某一单色电磁波的吸收程度,是受通过光的分子数及吸收率控制的,而与入射光的强度无关,这一规律称为兰伯特-比尔定律( Lambert- Beer Law):
I。
A=log---=&d
I
式中A为吸光度( A bsorbance,旧称光密度,即 Optical density)I。为入射单色光的强度,I为透射光,即通过样品后同一单色光的强度,&为克分子吸光系数(mla absorption coefficient旧称消光系数: molar extinction coef ficient,ι为样品厚度,c为样品浓度(克分子/升).
但在红外光谱中,大部分是用透光度( transmittance)来表示的:
I
T%=100×---
I。
I
log---=-&d=-A
I。
上式中最重要的是&值(一般是代表一个吸收带中吸收强度最高的频率的&值,也可称为&最高值)因为它表示了分子中某一运动对所吸收的特征电磁波的几率,&值可以很大或很小,也可表示某一特征吸收带的类型.一般说来红外要收谱的&值较小,例如烯类的C=C振动吸收峰的&值为2-50,羰基为100-1000,异氰酸基为1300,而在下一节外吸收光谱中可以看到,除一些禁忌跃迁外,一般吸收峰的&值都在一万至数十万之间。
三、仪器及一般操作情况
现在一般用于有机化合物的红外分光光度计,都是双光开朿而有自动记录装置的.分光用的设备分二种一一棱镜型和光栅型.用氯化钠制成的棱镜,可以通过波长直至15微米的红外光,而用氯化钾棱镜,则可达25微米,光栅型的则可延长到50微米,而且分光精密度可达到一个厘米1,因此新的仪器已逐步采用光栅型(九料化工https://www.999gou.cn/)。
下面是一个双光自动记录的红外分光光度计的示意图(图3.3.1)。
这样的仪器工作时,由光源发出波长连续的红外光被分成二个光束.一束通过样品池,另一束通过参考池二光线都经过不同途径通到由断续马达旋转的半圆镜处,断续马达每秒钟转十次,每次分别将样品池的光東(通过空的半面)和参考池的光束(通过半圆镜反射)交替通过狭缝和反射镜射入分光棱镜,成为一个完整的光谱而落在利特罗镜( Littrowminor)上.此由马达(1旋转,将光谱中的单色光依次地反射回分光棱镜(虚线所示的道路)再通过反射镜、狭缝而达到检波器(有些仪器用热电偶,有些用测辐射热器一1 blame.ter),变成电讯.由样品光東和参考光中的单色光交替变成的电讯经放大器放大后,二者强度之差即成为驱动光劈马达的动力,使光劈移动来减弱参考光東的强度使与样品池的相应单色光强度相等.记录笔是连在光劈上的,光劈移动而记录在蒙在记录鼓上的光谱卡上.光谱鼓的转动马达即是利特罗镜的转动马达,因它的转动是与单色光波长的转变同步的这样就可得到一张自动记录红外光谱卡.
在测定红外光谱的操作中,样品的制备是很重要的样品可分成固体、液体和溶液三种,分别简述如下:
1.固体样品:这又可分为三种:(1)石蜡油研糊(Nujolmull):将固体样品1-3毫克,与一滴医用石蜡油一起研磨约2分钟,然后将这糊状物夹在二片盐板中间,即可放入仪器的样品槽内测试.这一方法的缺点,主要是石蜡油本身在2900,1465和1380厘米-1段有强吸收峰,在解释图谱时,须先将这几个峰划去,以免误解.(2)熔融法:如果固体熔点在150℃以下或是胶状的,可直接夹在二片盐板之间熔融,然后测定其固体或熔融薄层的光谱.这一方法的缺点是固体往往有几种不同结晶,而结晶不同则光谱也有一定差异.同一样品如和石蜡油研糊相比,二者光谱可能出现差异.(3)肉化盐薄片( halide diso)将1毫克样品与300毫克无水氯化钾或溴化钾合匀研细后,放在金属模中,在真空下加压5分钟所形成的含有分散样品的透明鹵化盐薄片可以得到没有其它杂质的吸收光谱.其缺点是由于卤化盐易于吸水,有时不能避免在3500厘米1左右出现水的吸收峰,因此样品中是否存在OH基便会引起怀疑此外也可在薄片制备及保存过程中出现多晶现象.
2.液体样品:如纯化合物本身就是液体,则可很简单地将一滴样品夹在二片盐板之间使生成一极薄的膜,用于测定光谱.此外亦可将其放入一个极薄的氯化钠样品池中(0.0025-0.1毫米厚度).这样得到的光谱不能排除分子之间的相互影响(如氢键等),因此最好在惰性溶剂的稀溶液中测定一下作比较.
3.溶液样品:制备测定红外光谱用的溶剂,一般为四氯化碳,二硫化碳和氯仿.前二者应用较广,氯仿虽是一个强有力的溶剂,但有较强和较广阔的吸收带.一般溶液的浓度,大概在1%左右,置于0.5毫米厚度的盐池中.应用双光束分光光度计,可将纯溶剂放在参考池中,这样溶剂的吸收光谱便可抵销掉.事实上,溶液光谱比固体光谱可靠,因为这一方法可以选择溶剂,控制浓度及样品池厚度,而且分子在溶液中没有部分定向现象和多晶体的存在.
四、特征吸收带与化学结构的关系
我们在前面的讨论中,提到在红外光谱中,波长用微米表示,频率用厘米-1表示,二者可以并用,也可单用一种.由于1厘米=10,000微米,因此二者的换算便非常方便.
由于绝大部分的红外光谱波长在2.5-25微米之间,因此相应频率的波数在400-4000厘米-1之间.
分子中二个由键连接起来的原子的振动能阶提高所需的能量,相当于其吸收相同频率的光子,即:
△E振动=hν
而二个接连原子之间的振动频率是可用公式(1)算出的如果频率用波数表示,则
- 1 m1 m2
ν=-----√Κ/--------------
2πc m1+m2
式中C为以厘米为单位的光速,力常数Κ的单位为10 5达因/厘米,而折合质量(m1 m2/m1 +m2)的单位是氢原子的质量,为1.67339×10-24克.以光速C及力常数单位代入公式(6),则这一公式可简化为
- m1 m2
ν=1302.9√Κ/-----------
m1+m2
应用公式(7)时,Κ和折合常数的单位便可略去了.
力常数k值是正比于键能的,因此同为O一H,饱和烃类的值为4.8左右,芳香环的则为5,烯类的则为5.1,炔类的最高,为5.9.同是c-c键,一般为4.5,而六氯乙烷则为4.0.c=c键的键能比c-c键近乎高一倍,乙烯的C=C的Κ值为10.8,丙烯为9.45,数值虽不完全相同,但比c-c键大为增加则是显著的至于c≡c及c≡N,则增加的幅度更大,例如丙炔为14.7,Hc=N为17.9,乙为17.3.
一些原子对的力常数和折合质量的参考数值,见表
将以上的Κ值和折合质量代入公式(7)来计算ν,我们可以看到大都在后述的实测数值范围内.
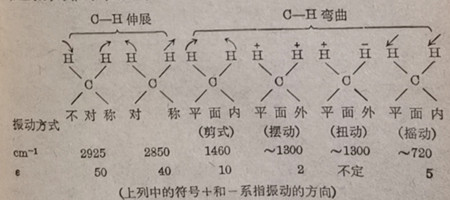
上面我们所讨论的原子对之间的振动,不过是原子对重要振动的一种伸展振动( stretching vibration),另一种振动方式,称为弯曲振动( bending vibration),又名变形振动( deforming vibration).展振动需要改变键长,所需能量较高,力常数也就高;曲振动不改变键长,因此所需能量较低,力常数ん也较低所以二类振动所吸收的红外光的波长也不相同.在上述二类运动中,每类还可细分成几种不同的振动方式,所吸收的红外光波长也是不同的,例如伸展运动可分成“对称伸展”(symmetric stretching)和“不对称伸展”( asymmetric stretching);而弯曲振动则更多,有在平面内和平面外的弯运动之分,其中又可分为剪式( SCISSOR),摇动( rocking),摆动( wagging)和扭动( twisting)运动下面是这些振动方式的示意:
分子内各个振动能阶虽然是量子化的,但应用连续单色光扫描后,所得光谱却不是线型的,而是具有波形的吸收带这是由于在振动能阶提高的同时,伴随着很多转动能阶的变化之故,这便出现很多靠得极紧的&值依次变化的吸收线,并起来成为一个波形的吸收带.每个吸收带的峰顶波长或波数,便称为这一吸收带的特征吸收波长或特征吸收频率.
表示分子中某一特征吸收频率强度的?,有随着红外仪器构造不同而有所差异的缺点,因此在红外光谱文献中,有时不写具体数值,而用强(st或s),中(m),弱(w)来表示.
实际上目前应用的特征基团吸收频率,都是从实测得到的,主要有以下几点原因:
(1)相同基团的吸收频率,一般都在一个较狭范之内,而对分子结构的影响较小例如环己酮与孕甾烷3-酮( pregnane-3-oe)虽然构造的复杂性相差很大,但其羰基的吸收频率几乎是相等的。
(2)另一方面,基团的振动频率还是受整个分子构造的影响的(如共轭效应、构象等),例如二个基团处于共轭状态时,都会因相互影响而有变化,如羰基和碳碳双键处于共轭状态时,二者的吸收频率都有降低:
CH3COCH?CH3 CH3CH2CH=CH2
C=0 1720厘米-1 C=C 1647厘米-1
CH3CO-CH=CH2
C=0 1685厘米-1 C=C 1623厘米-1
而氢键则对羟基和氨基的吸收频率和波形都能有较大的影响.
(3)一个有机化合物的吸收带,一般是很多的.在1400-3800厘米-1之间,很多吸收带是表示特征官能团的伸展频率的,因此对官能团的鉴定,很为重要从1400-650厘米-1,则吸收带很多,既有伸展吸收,也有很多弯曲吸收,除部分值强的吸收峰能加以解释外,很多是难以说明的但这一部分的图谱在鉴定化合物上很有用处,称为指纹区.假如一个化合物的指纹区与另一化合物(或已公布的图谱)在同一条件下测得的相同,即可认为是同一化合物。
(4)有些吸收带是由泛频( overtone,即比基本频率高一倍或几倍),综合带( combina tion bands,当单色光的波长适与二个基本频率ν1+ν2或ν1-ν2相等时会出现)和偶联作用( coupling,当二个频率极近的基团连起来时有此现象,例如C=C=C并不显出双键的特征吸收带,而显出二个强的偶联吸收带~1950厘米-1和~1050厘米-1等生成的.不过前二种情况?值很低,例如泛频仅为基本频率?值的1/10-1/100,对化合物的判断影响不大.
五、对红外吸收光谱的解析
这是测定红外光谱后的一项主要工作,现简明地分项介绍如下:
(一)对光谱吸收带的标绘法:在红外图谱中,各基团对红外光的吸收强度,有二种表示方法.一种是以吸光度(即光密度)表示的 I。
,即图谱纵坐标中1og---值从0开始到1-,数值愈高吸收愈强,波形峰顶的波长或波数即为特征波长或特征频率.另一表示方法 I
I
为透光率(T%,即---×100,图谱的纵坐标从0至100%,因此透光大的部分(即无吸收基的部分及值小的部分)的曲线在图的上
I。
面,而基团的吸收愈强则曲线愈向下降,因此以往讲的吸收峰,在这类图谱中事实上以“吸收谷”的形式出现了.不过在习惯上,对这些谷我们仍称为峰用那一种方法表示光谱,看仪器而定,我们在后面举的几个红外吸收谱的例子,是按透光率方法绘制的.
(二)对红外吸收图谱的初步划分对红外光谱,先将它划分下列八个区域(表3.3.3).
如果在上述某一区域中,没有吸收带,则表示没有相应的基团或结构.如果有吸收带,则按照下列次序作进一步的研究.
(三)对一些重要基团的区分.
(1)在3750-3000厘米-1之间有吸收带,可能存在着O-H和N一H伸展振动.
自由OH(无氢键的)的伸展振动范围在3700-3500厘米-1.苯酚的自由OH且吸收频率较低,约为3500厘米-1.
自由OH的吸收强度比生成氢键的为低,且只有在稀溶液中才能显出.
有氢键的OH,吸收范围在3450-3200厘米-1之间,显出较宽和较强的吸收带.
不成氢键的胺类吸收带在3500-3300厘米-1范围内,而生成氢键的胺类则在3500-3100厘米-1范围内这些吸收较OH吸收带强度低但比较尖峭伯胺出现二个吸收带,仲胺一个,叔胺无酰胺和内酰胺的N一吸收带也在3500-3300厘米-1之间.
羧酸在固体状态甚至在稀溶液中都以双聚体存在,因此并不在上述范围内显出吸收带,但强而宽的吸收带出现在3000-2500厘米-1之间.
(2)不同类型的C一H键,分别具有一定的伸展吸收区域,表3.3.4是一些主要C一H吸收带的大致位置:
表3.3.4主要C一H吸收带
从上表可以看出C≡C-H,C=C一H互和Ar-H都超过了3000厘米-1?,而脂肪族及醛类的一均低于3000厘米-1,此外还应注意到CH3和一CH2一都出现二个吸收带。
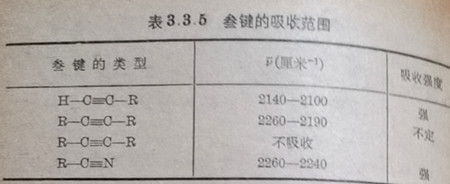
(3)叁键的对称伸展振动范围见表3.3.5.
共轭作用能使吸收波数略为降低例如芳香类的C≡N吸收范围为2240-2190厘米-1.而对称的烯类和炔类没有相应的C=C及C≡C吸收,是由于对称振动不能改变偶极矩之故.
(4)很多重要的图谱出现在羰基展振动的区域内,见表3.3.6.
表3.3.6羰基(C=0)伸展振动范围
共轭效应可使吸收带移向较小波数.而内酯的张力却提高了吸收的频率。
双键的对称性振动吸收与结构的关系,在1680-1600厘米-1范围内(表3.3.7):
表3.3.7双键的吸收范围
假使含>C=C<结构的化合物所带基团很类似,因而降低其极性(例如带有四个不完全相同的烷基乙烯行生物),则吸收强度可降至极低.
芳香系统可在1400-1500厘米-1波段内出现一个或几个较强的吸收带.
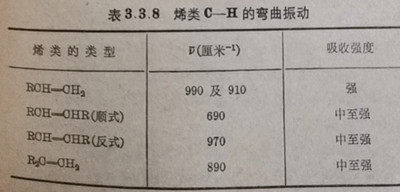
(5)在1000-650厘米-1范围中的一些C一H弯曲振动,可对烯类和芳香环的替代情况提供有用的信息(见表3.3.8,3.3.9)
表3.3.8烯类C一H的弯曲振动.
(四)对一些红外光谱的分析例:
1.下面是一个红外光谱的一部分(图3.3.2),分所一下可能有哪些基团存在,哪些不存在:
应用本小节(1)的八个区域划分法,对可能存在和不会存在的基团作如下分析:
可能存在的基团
波数范围(厘米-1)
760-3000 NH或OH(伸展)
3300-2700 各个C一H(伸展)
2400-2100 C≡C或C≡N(伸展)
1475-1300 C一H(弯曲)
不存在的基团
1900-1650 CO(伸展)
1675-1625 C=C(伸展)
2.下面一个图谱(图3.3.3),化合物分子式是C8H8O,试解释下列三个问题:(a)氧在这个化合物中属于哪个官能团类型;(b这一化合物是否属于芳香族,是否还含有脂肪属的碳原子;(C)假使它是一个芳香化合物,是一个怎样替代的环?
根据图谱,作如下分析:(a)在3500-3300厘米之间缺乏强吸收带,表示无OH基在1690厘米-1的CO吸收带说明有酮、醛或酰胺的可能,但分子中无N,因此排除了酰胺。
在2720厘米-1无吸收带,排除了C=C-H基的可能性,因此这一化合物系酮类:(b)在3000厘米-1以上有C一H伸展吸收,说明可能有芳香环的存在,结合在1600,1580和680厘米-1有强吸收带也说明这一化合物有芳香环、在2920,2960和360厘米1有吸收带表示有甲基;(C)在700和750厘米-1附近有二个吸收带表示是单替代芳香环.
从上面的分析,再结合所给的分子式读者不难看出这个化合物是苯乙酮了.
(五)一些重要基团及骨架的特征红外吸收范围(表3.3.10).
六、红外吸收光谱在有机化学中的应用
红外光谱是目前有机化合物研究中用得最多的方法,这里只扼要地讨论一下在有机合成中的应用.
(一)对化合物的鉴定:我们在前面已经谈过在1400-650厘米-1波段,称为指纹区.除极少数化合物外(如在H3(CH2)nCH3中,n=76与n=77不能用红外光谱区别),只要二个化合物的红外光谱(尤其是指纹区)相同,便可认为是同一化合物,分子式相同而构造相似的不同化合物,如顺式和反式,非对映光学异构体等,在红外光谱上都有区别,因此合成了中间体或最后产品后,如有光谱可査的(如萨德勒”标准光谱: The Sadtler Standard Spectra的红外部分),只要用同一条件做一红外光谱核对一下,便可确定是否同一物质.如无光谱可查,也只要与标准样品的红外图谱比较一下即可确定。
(二)对合成的天然化合物的确定:二个光学对映体的图谱是相同的.在固体状态时,一个光学活性异构体同它的外消旋混合物的红外光谱是不同的,但在溶液中,则二者并无区别.后一现象对天然化合物的合成研究极为有用因为天然化合物往往只存在对映体的一种,而合成物总是一对对映体并存的外消旋混合物.应用这一现象,便不需将外消旋混合物进行麻烦的光学分离后再确定所需的化合物的外消旋体是否已经合成。
(三)鉴别官能团及结构类型:这方面已在上文中讨论过了,进一步的深入,可参阅L.J.贝拉米著的复杂分子的红外光谱中译本(1975年科学出版社出版)。
(四)杂质的检查:如样品中杂质较多,其图谱与标准图谱比较会出现糊现象,如在参考池内用纯样品配成溶液,则主要化合物的吸收带可抵销掉而出现杂质光谱。
(五)对反应进行程度的测定:在反应过程中,总是伴随着一些基团的消失和另一些基团的出现.因此在反应中间定时取出少量样品测定光谱,观察一些关键吸收带的消失和生成,便可推测反应的程度并进行动力学的研究。
(六)定量分析:用红外光谱作定量分析,误差在5%左右,虽不如紫外光谱灵敏,但对任何化合物都能应用。













































![1-[[4-[(二甲基苯基)偶氮]二甲基苯基]偶氮]-2-萘酚](images/202512/thumb_img/6343_thumb_G_1764743745707.jpg)

.jpg)
.jpg)
.jpg)
.jpg)
.jpg)


.jpg)
.jpg)
.jpg)