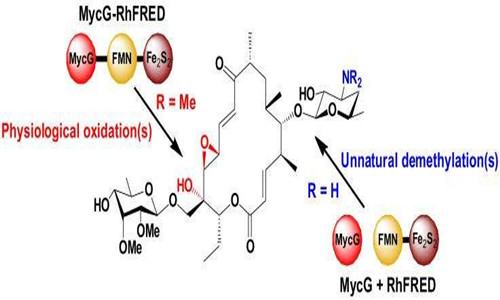
- 气相色谱的流程及色谱图

- 对于流出气体中被分离组分的检测及测量方法可分为二类:积分式检测和微分式检测。前者是将流出气体中各组分所产生的信号加和性地记录下来,因此洗脱曲线(检测信号对时间或流出物的容积作图)为一系列阶梯形曲线(图15-2a);而微分式检测器记录流出气体的某一瞬间的性质,因此以载气为基线,各组分则以对称峰形出现(图15-2b)。
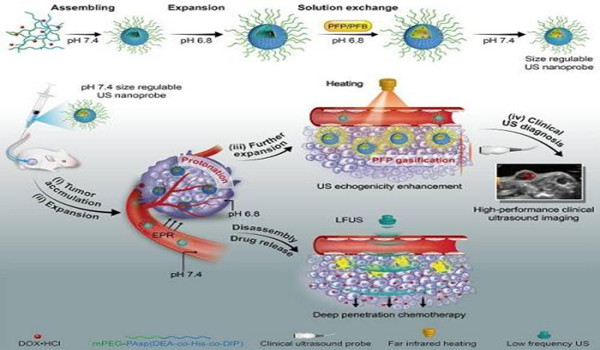
- 甲烷单加氧酶还原酶MMOR的结构

- Muller等采用NMR结合局城性分子动力学计算研究了MMOR的结构[]表明,还原酶(sMMOR)有2个城,一个是含有FAD和NADH结合部位MMOR-FAD城,分子量为27. 6kDa,由250(99~348)个氨基酸组成;另一个是含有[2Fe-2S] 的铁氧化还原蛋白城(MMOR-Fd), 由98(1~98)个氨基酸组成,6个β带(strands), 3个a螺旋构成了2个β片, [2Fe-2S]中心与42、47、50、82半胱氨酸残基的硫原子配位,分子量为10. 9kDa,MMOR总分子量为
- 甲烷单加氧酶调节蛋白MMOB的结...
- 调节蛋白B的分子量大约是16kDa,由7条β链构成两个β带,这2个β 带成直角,通过3个a螺旋,互相垂直交联在一起,邻接部分呈现螺旋趋势,但较混乱。N端易受蛋白影响发生水解,N端水解后缩短了MMOB的链长度。基因重组的MMOB与天然MMOB相比,和MMOH结合的亲和性有所降低。甲烷羟基化反应的效率,取决于MMOH和MMOB在催化过程中的相互作用动力学。整个蛋白质表面呈现疏水性,在酶系统反应中只对MMOH一些关键部位的结构和功能起调节作用,没有直接参与酶的催化反应。Walters等[42]利用NMR
- 气相色谱的优点与特色是什么?

- 气相色谱与液相色谱相似,只是以气体作流动相,它的分离机理也是基于物质在流动气相和固定相(可为固体和液体)两相间分配的不同而导致分离。Martin和Synge于1942年建立了液-液分配色谱的理论模式。同时提出了以气体作流动相色谱分离的可能性。后James和Martin终于实现了气-液色谱的实验。从此,气相色谱因其独特的分离功能而得到飞速的发展。
- 甲烷单加氧酶的谱学表征
- MMOH 结构的谱学表征:一系列谱学研究表明,MMOH双核铁中心含有一个μ-氢氧桥(pr-hydr-oxo)结构,容易发生诱导变形,在反应循环过程中受其它组分影响,可以随外部环境的变化而改变。联合使用多种谱学手段对MMOH的结构变化进行表征,有助于阐明MMO的反应机理。根据文献报道,在结构化学中常用的各种现代光谱和波谱技术,都可以用来研究MMOH双铁核中心的构型变化。它们包括ESR (electron spin resonace, 顺磁共振),Mossbauer, EXAFS(ex-tended
- 甲烷MMOH双铁核中心构型

- 甲烷和分子氧的活化机理:为了阐明MMO可能的反应机理,Rosenzweig 等对Bath菌的MMOH晶体分别在4C、- 160C进行XFA表征。证明在一160°C时,双核铁中心由4个谷氨酸、2个组氨酸、1个乙酸基配位,但在4C时,乙酸配基则被水分子取代。因此在4C和一160C情况下,活性中心的构型是不同的,如图3-3所示。Shu等研究了OB3b的MMOH晶体活性中心结构,得出了同样的结果。
- 甲烷 羟基化酶的晶体结构
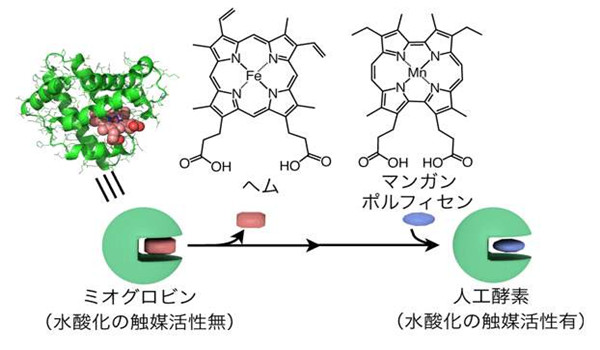
- 为详细了解甲烷单加氧酶的空间结构信息,1993年,Lippard领导的科研小组首先在Nature上报道了M.capsulatusBath菌的羟基化酶晶体结构,在学术界引起极大兴趣。
羟基化酶经过纯化以后,他们对缓冲液、盐浓度沉淀剂、温度、pH、蛋白质浓度等结晶参数进行了1000 多次筛选,首次用真空扩散法获得了Bath菌的MMOH晶体,并进行了X光单晶街射分析。
- 甲烷单加氧酶的总体构型

- 甲烷单加氧酶( methane monooxygenases, EC1.14. 13.25)的分子量约301kDa,研究比较深入的是可溶性甲烷单加氧酶sMMO,它包含三个组分:羟基化酶(sMMOH, 220~ 250kDa)、还原酶(sMMOR, 38~ 41kDa)和调节蛋白B (sMMOB, 15~ 18kDa). sMMOH是由三个亚基组成的二聚体(aβr)2,每个单体有一个双核铁活性中心,位于羟基化酶的a亚基上,a亚基既含有a螺旋也含有β折叠,也是sMMO中唯一存在β折叠的亚基,活性中心的
- 什么是甲烷单加氧酶的结构与反应化...

- 单加氧酶泛指在结构、生物化学和生物进化上完全不同的一系列酶,这些酶能够催化O2与不同的有机、无机底物发生反应,在原核、真核微生物的分解代谢、消除环境污染物中发挥着重要作用。
- 甲烷单加氧酶中组分D-orfY的...

- 在第一个甲烷单加氧酶的基因序列测定中,就发现在整个基因序列申有一个小的开放阅读框,编码为orfY,但迄今尚未从甲烷氧化细菌中分离出该蛋白,对它的功能也不清楚。该基因位于mmoZ与mmoC之间,分子量约12kDa,称为MMOD,如图2-2所示。Merkx 对这个位于mmoZ与mmoC之间,功能未知的片断orfY,在E.coli 中进行了克隆表达,获得了纯的MMOD蛋白,通过WestenBolt分析,在Bath中确有MMOD存在。一个可能的解释是该蛋白组装在MMO双铁核中心内,其功能是通过MMOD与MM







