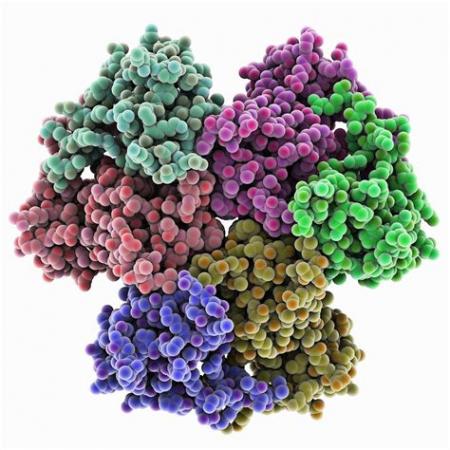
甲烷单加氧酶还原酶MMOR的结构
化学先生 / 2019-07-30
Muller等采用NMR结合局城性分子动力学计算研究了MMOR的结构[]表明,还原酶(sMMOR)有2个城,一个是含有FAD和NADH结合部位MMOR-FAD城,分子量为27. 6kDa,由250(99~348)个氨基酸组成;另一个是含有[2Fe-2S] 的铁氧化还原蛋白城(MMOR-Fd), 由98(1~98)个氨基酸组成,6个β带(strands), 3个a螺旋构成了2个β片, [2Fe-2S]中心与42、47、50、82半胱氨酸残基的硫原子配位,分子量为10. 9kDa,MMOR总分子量为38. 5kDa; MMOR-Fd从NADH向MMOH转移电子,Fd与MMOH结合面有一个极性中心,这个中心被一些疏 水基团包围。
甲烷与氧在活性中心的反应过程中,活性中心的疏水腔起着关键性作用7.25,非极性的底物转化成更亲水的产物,在酶分子中必定有一个互不干扰的结合释放路径。假定这个路径是从蛋白质分子表面到活性中心,气态的底物首先结合在分子表面的疏水腔,通过MMOH分子构型的扭动变形,逐步结合到活性中心。为了探测这一机理,Whittington 等采用二溴乙烷、碘乙烷与MMOH共结晶的X光衍射方法,通过氙、二溴乙烷、碘乙烷对MMOH晶体加压,研究了小分子与MMOH的结合部位。证明二溴乙烷、碘乙烷结合到a亚基的2个疏水部位,氙结合到a亚基的6个疏水部位。从而阐明了非极性底物结合在疏水腔体内,MMOH分子中的疏水腔起着路径引导作用,从而支持了前面的假设。特别是从活性中心Leul10侧链构型的改变推断,Leul10就是一个疏水通道的重要组分,控制着底物的进人和产物的释出。
多种谱学方法都曾用来探究MMOR的结构及其与MMOH的结合。采用特殊残基的NMR研究,也可以了解MMOB和MMORFd与MMOH的相互作用。小角度X射线街射研究则表明,有一个MMOH-MMOB-MMOR结合的三重化合物模型,在反应循环中使MMOH经历了一个大的结构重排。在MMOH表面对正电性残基的修饰,可抑制其与MMOB结合和从MMOR转移电子。MMOH的双铁核中心和MMOB中心的距离测定表明,MMOB与MMOH是相邻接的。MMOH和MMOB共价交联的质谱分析证明,MMOR-Fd的Glu5b、Glu91 连接到MMOH的a亚基N端和两个羧基形成的负电区。但突变实验则表明,除此之外还可能有其它交联位点存在。
来源于Bath菌的MMOH紫外光谱在300nm有吸收,而蛋白质的吸收在280nm,这个吸收峰很可能是由双核铁中心产生的。这一点与早期OB3b的MMOH实验结果相一致,而在其它报道中认为,MMOH在410nm、521nm、550nm也有不同的特征吸收峰[54],可能与样品的酪氨酸残基有关。