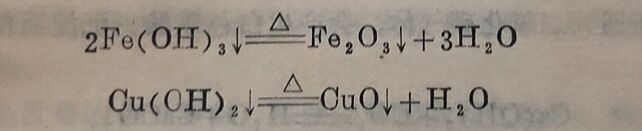碱的共性与组成
铜臭 / 2022-07-18
一、碱的组成和命名
碱的水溶液能电离出金属阳离子(包括NH₄⁺)和氢氧根阴离子(OH⁻),例如:
NaOH=Na⁺+OH⁻
Ca(OH)₂=Ca²⁺+2OH⁻
NH₃+H₂O=NH₄⁺+OH⁻
可以看出,碱电离后生成的阴离子全部 都是氢氧根离子 (OH⁻)。化学上把在电离时所产生的阴离子全部是氢氧根离子的化合物叫做碱。
必须指出,如化合物在电离时,除生成氢氧根离子(OH⁻) 外,还生成其它阴离子的, 那就不属于碱类。例如碱式碳酸铜{Cu₂(OH)₂CO₃},在电离时所生成的阴离子除氢氧根离子外,还有碳酸根离子:
Cu₂(OH)₂CO₃=2Cu²⁺+2OH⁻+CO₃²⁻
故它不属于碱类,而属于盐类。 因此必须强调,化合物在电离时所生成的阴离子“全部”是氢氧根离子的才是碱。
氢氧根的化合价总是-1价,因此某金属离子的化合价必等 于和它相结合的氢氧根数。例如: 氢氧化钠( NaOH)、氢氧化 钙{Ca(OH)₂}和氢氧化铁{Fe(OH)₃}中,钠(Na)是+1价、钙(Ca)是+2价、铁(Fe)是+3价。写碱的分子式时,把金属元素写在前面,氢氧根写在后面,如氢氧化钠(NaOH)。如果分子式中氢氧根不止一一个,就要把氢氧根(OH⁻)用括号括起来(因为OH⁻根是一个原子团),并在括号右下角注明个数,如氢氧化钙{Ca(OH)₂}。
碱的命名一般是在“氢氧化”三字后面加上分子中金属元素的名称,例如Mg(OH)₂叫做氢氧化镁、Ca(OH)₂叫做氢氧化钙。如果某金属离子具有几种化合价,那么把高价金属离子的碱叫做氢氧化某,而把低价金属离子的碱叫做氢氧化亚某。例如一般铁 的化合价有+3和+2两种,它们相应的氢氧化物的分子式和名称 是: Fe(OH)₃叫氢氧化铁和Fe(OH)₂叫氢氧化亚铁。
二、碱的共性
碱的分子中除氢氧根外,还有金属离子。由于各种碱的金属离子不同,所以各有其特性。各种碱除仍保持其金属离子的特性外,物理性质也不相同。一般常见的碱除NH₃是气体外都是固体。大多数碱是白色,但也有呈不同颜色的,如氢氧化铜{Cu(OH)₂} 显浅蓝色,氢氧化铁{Fe(OH)₃}显红棕色。各种碱的溶解度不相同: NaOH和KOH的溶解度较大,Ba(OH)₂次之, Ca(OH)₂稍溶于水,其它的碱一般都不溶于水。 各种碱的碱性强弱不同, 除NaOH、KOH和Ba(OH)₂为强碱,Ca(OH)₂为中强碱外,其余一般都为弱碱。
由于碱中都有氢氧根,因此它们又有共同的性质,如碱的水溶液都有涩味和滑腻感。碱类的共同化学性质,主要有以下几方面:
1.碱的水溶液能使酸碱指示剂变色。碱溶液能使红色石蕊试纸变为蓝色,使酚酞指示剂变为红色。
如以氢氧化钠溶液润湿红色石蕊试纸或向盛NaOH溶液的试 管中滴加2 ~ 3滴酚酞指示剂,可以看到红色石蕊试纸变蓝色,滴入无色酚酞试液的溶液显红色。由此可见,氢氧化钠溶液呈碱性反应。用石蕊试纸和酚酞液试其它的碱溶液,如Ca(OH)₂和NH₃的水溶液,也得同样的结果。
2.碱和非金属氧化物作用生成盐和水。例如,氢氧化钠(NaOH)和二氧化硅(SiO₂)作用,生成硅酸钠(Na₂SiO₃)和水:
2NaOH +SiO₂=Na₂SiO₃+H₂O
此反应在温度高时作用很快,温度低时作用缓慢。
因玻璃成分中含有二氧化硅(SiO₂),所以装氢氧化钠溶液的玻璃瓶子要用橡皮塞,不能用玻璃瓶塞,否则会使玻璃瓶口与瓶塞生成粘性的硅酸钠而粘结在一起,不易打开。
又如氢氧化钠和二氧化碳反应生成碳酸钠和水:
2NaOH+CO₂=Na₂CO₃+H₂O
因此氢氧化钠固体或溶液都不宜在空气中久放,因它会和空气中的二氧化碳反应变成碳酸钠。所以存放氢氧化钠的容器应密封,以免变质。
3.碱和酸作用生成盐和水。例如:
NaOH+ HCl=NaCl+H₂O
Ca(OH)₂+H₂SO₄=CaSO₄+2H₂O
我们把碱和酸作用生成盐和水的反应叫做中和反应。中和反应具有广泛的用途,如分析化学中测定酸或碱的浓度,水处理工艺中废酸碱的处理等。
4.碱和盐作用生成新碱和新盐。例如氢氧化钠溶液和氯化铜溶液反应生成浅兰色氢氧化铜沉淀(新碱)和氯化钠(新盐)。
2NaOH+ CuCl₂=Cu(OH)₂↓+2NaCl
5.碱的加热分解。不溶性的碱,受热后可分解为氧化物。各种碱分解的难易程度不同,如氢氧化铁(红棕色)需经过焙干和灼烧后,才能成为三氧化二铁(红棕色),而氢氧化铜(浅兰色)即使在水中加热,也能分解为黑色的氧化铜(下式中“△”表示加热)。
但可溶性的碱(如NaOH和KOH)受热后不会分解,即使加热至熔融和蒸发也不分解。