

![1,8-二氮杂二环[5.4.0]十一碳-7-烯](images/201812/thumb_img/1103_thumb_G_1545291985569.jpg)


























学习了原子结构和周期律理论,我们已经知道,元素和它的化合物的性质与它的原子结构有着密切的内在联系.周期表中的同主族元素具有相同的最外层电子数,这就反映在它们的最高化合价都相同,;它们的性质也非常近似.但由于同主族元素的电子层数的逐渐递增,使它们的性质也显出规律性的递变.这些事实,当我们复习一下已学过的卤族和氧族元素的性质时,就能得到印证。
现在,我们将分别学习周期表里的其他各族元素.本章研究第主族元素一一氮族元素.
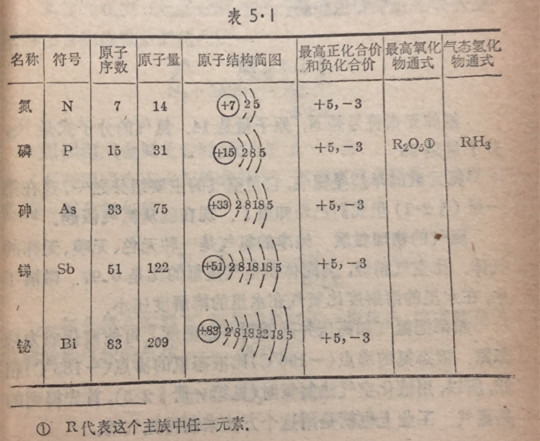
氮族元素包括氮、磷、砷、锑、铋五种元素.根据原子结构和周期律理论,它们的结构和主要的化学性质等,都应有很多
的类似性和规律性.现在把它们概括列出如表5·1。
从这些元素的原子结构不难看出:由于这族元素的最外电子层有5个电子,接受外来电子的倾向较失去电子的要大,因此,可以预测它们的性质基本上是属于非金属类型的,当然,它们的非金属性较卤族、氧族元素相对地都要弱一些,特别是锑和铋,由于电子层数的增加,已显出较强的金属性了。
在这一族里,氮和磷是具有代表性的元素,它们和它们的化合物对动植物的生命和工农业生产都具有重要的意义此,本章重点学习氮和磷。