地球表层的挥发性物质的元素是以什么样的化合物形式逸出的呢?欲了解这一问题,测定了这些元素间所能结合成的化合物的生成常数,然后解这些联立方程就行了。鲁比(W.W. Rubey,1955)所用的反应方程式和平衡常数列于表表4.2(D.J.Brancazio和A.G.W.Cameron,1963)。解这些方程式可知,它们是以H2O,HCl,CO2,N2,H2S,Ar等形式逸出的。在这些计算中对H2和O2量的估计是很重要的,倘若大量的H2充分地存在于原始大气中的话,那么上述逸出的化合物应成H2,H2O,HCl,CH4,NH3,H2S,Ar的形式。

依据休斯(H.E.Suess)、尤里(H.C.Urey)等人作出的宇宙中元素平均存在量的表,像H2以及He那种原子量小的元素占压倒多数,而氢原子数约为氧原子数的2×103倍之多。在地球以外行星的大气中,氢的含量如图4.2所示:
因为地球的质量并不怎么大,所以认为氢也全部逃逸到地球大气圈外去了(北野1967,1969)。研究生命起源的人们一直支持大气圈外有H2存在的观点。然而,挥发性物质从地球内部逸出时,它们当然要和矿物相接触,霍兰(H.D.Ho-lland,1968)这样认为:当挥发性物质从炽热的原始地球中通过时,其与彼时可能处于均匀分布着的金属铁和硅酸盐等构成平衡状态。氧和氢的分压由下述两个反应式决定:
Fe2SiO4⇌Fe+FeSiO3 +1/2O2
H2O⇌H2+1/2O2
解这两个方程式,得到:
[H2]/[H2O]≈2。因水量是已知的,故可算出H2的量。松尾添加上该计算的氢量,推测出如表4.3所列挥发性物质的化学形式(松尾,1968)。
表4.3初期逸出的气体化学组成(容积百分比)(松尾,1968)
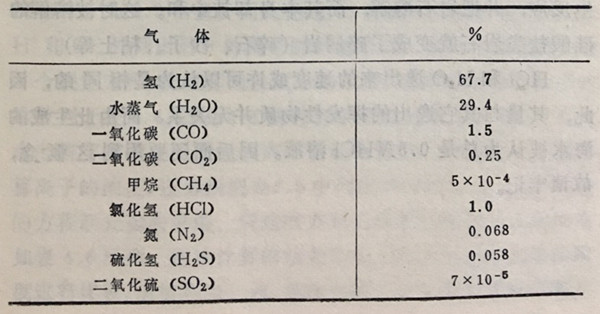
这样就很清楚,氮以N2形式,C变成CO和CO2逸出地球。不久,铁的地核一形成,终于因为在地幔里已经没有了铁,所以这时氢的分压由下述两式决定:
3Fe2SiO4 +1/2O2⇌3FeSiO3 +Fe3O4
H2O⇌H2+1/2O2
因此,[H2]/[H2O]≈0.01这和鲁比提出的值相一致(表4.1)。原始地球的挥发性物质的形态为什么是还原形的?关于这一点也有争论,但是,从常识来看,从还原型渐渐地转变到氧化型化学形式的组合并不困难吧(P.J.Brancazio and A.G.W.Cameron,1963)。不管怎么说,这样的气体逸出地表,不久温度一降低就生成了液态水,并且HCI很容易就溶解在这水中。其浓度若由表4.1;换句话说基于现在地球表面的挥发性物质来考虑,则为0.3NHCl溶液。这时N2(以NH3的形式溶入这0.3NHCl溶液,但是因NH3的量比起HCl的量来小许多,故不引起0.3NHCl浓度的改变),CO,CO2(或CH4)很难溶于这种0.3 NHCI溶液而存在于大气中,这就构成了大气的成分。该0.3NHCI溶液可能立即和岩石发生反应,并把岩石溶解,而其本身却被中和。这时被溶解的硅酸盐类岩石就变成了碎屑岩(碎石、沙子、粘土等)。
HCl和H2O逸出来的速度或许可以认为是相同的,因此,其量与其它逸出的挥发性物质并无关系,而由此生成的海水被认为总是0.3NHCI溶液。因后面还要用到这概念,故请牢记。