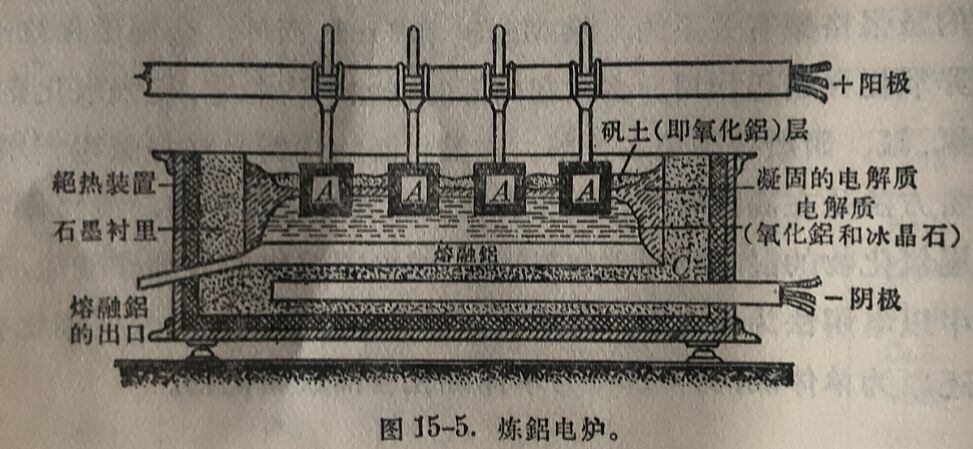
在电解的过程中,按时地加入 Al₂O₃, 并放出所产生的金屬鋁,金屬通常含有98-99% 鋁,主要杂质为Si与Fe以及微量的Ga。因为提純鋁很困难,所以在制銘时需用极纯的原料。所用冰晶石是人工制造的,是将Al(OH)₃和 碳酸鈉- -同溶入氫氟酸而制得:
2Al(OH)₃+12HF+3Na₂CO₃= 2Na₃[ AIF₆]+3CO₂+9H₂O
天然的鋁土矿通常含有40-60%Al₂O₃,余为SiO₂、Fe₂O₃等杂质,必须加以化学处理以除去。主要处理方法是将鋁土矿与碱共热,氧化鋁即变为鋁酸盐而溶解,然后通以二氧化碳,氢氧化鋁即沉淀析出:
Al₂O₃+2OH⁻+3H₂O=2[Al(OH)₄]⁻
2[Al(OH)₄]⁻+CO₂=2Al(OH)₃+CO₃⁻⁻+H₂O
二、鋁的性质
鋁为銀白色金屬,有很高的电导率,鋁的电导率为铜的60%,但比重只有第的30%,故等长和同重量鋁钱的电导性有铜钱的两倍。鋁有很大的延展性;它可抽成细絲,银成薄片或錘为鋁箱。虽然它的抗張强度仅为第的1/4,但若加少量(百分之儿)的第,强度即大增,不过同时耐腐触性也降低。
纯鋁在空气内无作用,在水内也不受腐触,即使在高温也不与蒸汽反应,这皆是因为鋁的表面有氧化物层保护的缘故。它也不 为硫化氢所使触,但溶于大多数酸内,也溶于烧碱内, 有机酸如乙酸和檸檬酸亭冷时不与之作用,但在100°C时即起使触作用。洽硝酸,不喻濃稀,对鋁都无作用,加热即发生猛烈反应。
如强热鋁的粉末或薄箔,鋁即着火燃燒而发生眩目的亮光并;生成氧化鋁。燃燒时,每克鋁放出7.47千卡热,比其他金属和氧化合时所放出的热量要大得多,因其与氧有高度的亲合力,故鋁常用于使其他金属从难于还原的氧化物内分离出来,同时并产生高温使分离出来的金屬熔为流体。因此,鋁粉与其他金屬氧化物的混合物称鋁热剂。鋁热剂法不仅骨用于制备許多游离的金属,如Cr,Mn,V等,而且也可用于金屬的焊接。例如,用鋁与四氧化三铁所租成的鋁热剂常用于焊接铁軌,这种鋁热剂的反应为
8AI+3Fe₃O₄=4Al₂O₃+9Fe Q=795 千卡
其温度可达3500°C。此外,鋁热剂还可用于熔化鑭的碎片。
鋁的最主要用途是作成各种經合金而应用于航空工业及汽車工业上,在鋁內加入少量的其他金屬,并不增加多少鋁的比重,但却能大大地提高鋁的强度,这些合金中最重要是鎂鋁(含鎂10-30% )和坚鋁(含有93-95%左右的鋁、2.5-5.5% 銅、0.5-2% 鎂、0.5-1.2錳和0.2-1%硅)。鋁的另一重要用途是用于进行所謂渗鋁,即将鋁渗入銅或生铁物体的表面,以防止于受热时被氧化。在冶炼鋼铁时,鋁用作去氧剂以除去熔铁内的氧化物。鋁的細粉可作为顏料而用来塗盖铁,以防止铁的腐蝕。銀色油漆就是将鋁粉与千性油混合而制成。
鋁的电极反应几乎是不可逆的,它的电位很难加以测定。表15-1内的数值1.66伏,是从热化学数据計算出来的,并表示鋁的电正性約与普通金屬鎂相似。鋁整流器就是利用鋁电极的这种不可逆性,以使交流电变为直流的脉动电流。鋁整流器是由鋁及铁(或鉛)的电极插入苏打或磷酸盐溶液中而粗成。当鋁作为阳极时,电极有极高阻力,作为阴极时,則阻力很小,因此,鋁整流器可使交流电的一半通过,另一半通不过。