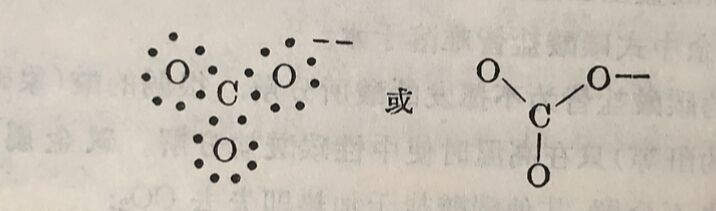1.碳酸和碳酸盐
二氧化碳的水溶液显弱酸性,使石 蕊变杠。由此可知二氧化碳在水内有一部分变为碳酸,后者离解为离子:
H₂CO₃=H⁺+HCO₃⁻
HCO₃⁻=H⁺+CO₃⁻⁻
这两步的离解常数在25°C时是K₁=4.45x10⁻⁷,K₂= 5.7x10⁻¹¹由于碳酸的酸性很弱,它的盐在溶液内为水所分解:
M₂⁽ᴵ⁾CO₃+H₂O=M⁽ᴵ⁾OH+M⁽ᴵ⁾HCO₃
M⁽ᴵ⁾HCO₃+H₂O=M⁽ᴵ⁾OH+H₂CO₃
因此,碳酸盐溶液显碱性。这不仅中性盐如此,酸式盐也是如此。碱金屋、碱土金屋和少數其他二价金屬的酸式碳酸盐皆存在,并且除酸式碳酸鈉(或称碳酸氫鈉)外,余皆易溶于水。苏尔雜和侯德榜制碱法都是利用碳酸氢鈉有較低溶解度的性质,将其从溶液内分离出来,碳酸氢鈉在溶液內加热即失去CO₂而轉变为中式碳酸鈉。中式碳酸盐主要是由一价和二价金属所形成,除碱金屬的碳酸盐外,其余中式碳酸盐皆难溶于水。
所有的碳酸盐皆为不揮发的酸所分解。很弱的酸(象研酸、 硅酸和它們的酐等)只在高温时使中性碳酸盐分解。破金局碳酸盐虽程熔化也不分解,其他碳酸盐于加热即失去CO₂:
M⁽ᴵᴵ⁾CO₃=M⁽ᴵᴵ⁾O+CO₂
2.甲酸和甲酸盐
精甲酸(或称蛾酸)是无色而有刺鼻臭味的波体,皮肤触及即起疤。柏加冶却即基精为固体,在8.43°C熔化。满点为100.6°C它与水完全溶合。
甲酸是很强的还原剂,能使贵金属从它們的盐中还原分出,并与氯化采按照下式反应:
HCOOH+2HgCl₂=CO₂+2HCl+Hg₂Cl₂
用銠粉为催化剂,甲酸在常温时即分解为氩和二氧化碳:
HCOOH=H₂+CO₂
3.乙酸和乙酸盐
乙酸HC₂H₃O₂又名醋酸,是酸醋中的主要粗分。它是无色液体,有刺激臭味,虽极稀的溶液也呈酸味。无水乙酸容易凝固;固体的熔点是16.7°C,沸点118.1°C。它与水、乙醇、三氯甲烷、甘油可完全混溶。它是一种弱酸。作为一个弱电解质,乙酸的电离作用与阿侖尼烏斯的理論符合。
乙酸盐,除銀和汞⁽ᴵ⁾盐外,皆易溶于水,其中应用最广的是乙酸鈉。乙酸 鈉极易溶于水,幷容易从水内秸晶出来,晶体是三水化物NaC₂H₃O₂· 3H₂O,在75°C时熔融,幷溶解在自己的秸晶水内,在約120°C时就完全脱水。无水盐在319°C熔化。乙酸鈉常用于“缓冲”乙酸溶液,使溶液的酸度降低,并在定限度内不使有显著改变。



























![1,8-二氮杂二环[5.4.0]十一碳-7-烯](images/201812/thumb_img/1103_thumb_G_1545291985569.jpg)