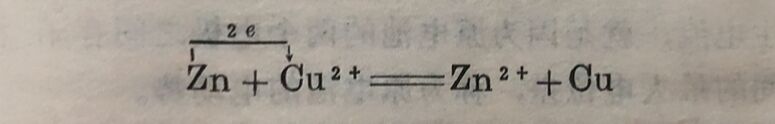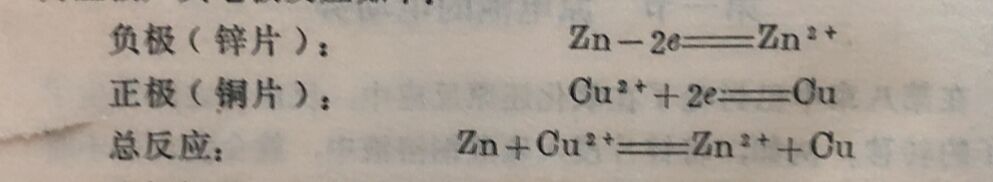金属不仅插在纯水中会产生电位差,插在其盐溶液中也同样会产生电位差。金属插入水中时有以下平衡:
Me⇔Meⁿ⁺+ne
当金属插在其盐溶液中时,即溶液中有Meⁿ⁺时,必使平衡向左移动,最终建立了新的平衡,产生一定的电位差。
金属在其盐溶液中可能有两种情况:
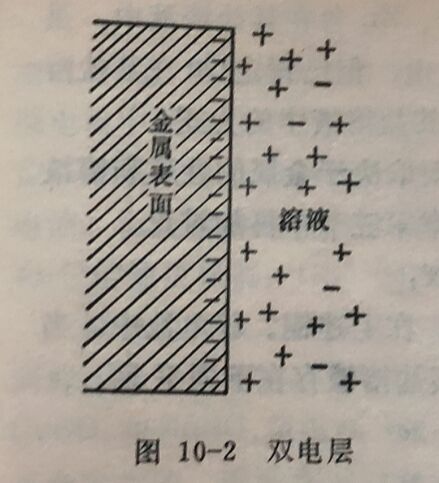
(1)如果金属上的离子较易进入溶液,则此金属仍带有负电荷(即金属带有过剩的电子),只是比它在纯水中时要少些。这些电子与金属附近水层中的金属离子组成双电层,产生电位差(金属附近的水层中也还有阴离子和与其等电量的金属离子,但不影响电位)。离子愈易进入溶液,则金属上带的负电荷愈多,产生的电位差愈负。
(2)如果金属上的离子不易进入溶液,则此金属可能带有正电荷,即溶液中的部分金属离子可能沉积在金属表面上。这些金属离子与金属附近水层中的阴离子(由于金属离子沉积到金属上而使溶液中有过剩的阴离子)组成双电层,产生电位差。显然其值较上一种为正。
目前尚不能肯定哪些金属在其盐溶液中带正电,哪些带负电,但它们的祖对性已经测定。如Cu、Zn和各在其盐海液中、不能肯定Cu⁻定带正电。Zn一定带负电,但已肯定Cu在其益空液中产生的电位差(即电位)比和在其盐溶液中的为正。
金属与溶波间电位差的大小主要取决于金属的性质和咨波中全属离子的活度。
2.原电池产生电动势和电流的机理:
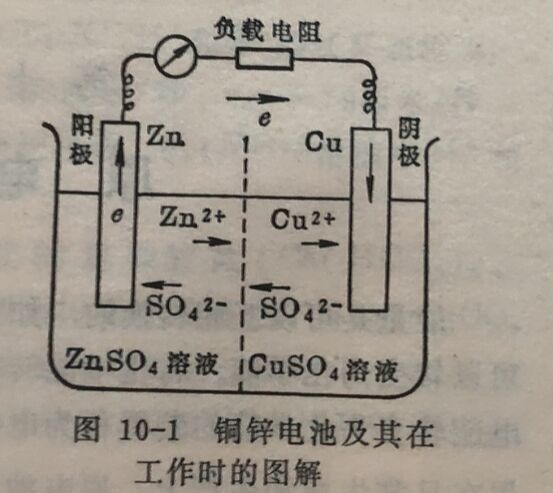
(1)愿电池产生电动势的机理。在上述铜、锌电池中,当导线未将两极接通时,Zn和Cu各与其盐溶液存在下列平衡:
Zn⇔Zn²⁺+2e
Cu⇔Cu²⁺+2e
Zn与Cu各与其盐溶液的接界面上存在着不同的电位差,亦即锌、铜两极各有其不同的电位,两极之间存在着电位差。原电池的两极处在平衡状态时的电位差。称为原电池的电动势。
当导线将两极相连时,由于两极间存在电位差电子从电子较负的极(锌授),通过导线流向电位较正的极(铜极),并道 过溶液,构成回路。因组成电池的电解质溶液( ZnSO₄和CusO₄溶液)有电阻,金属导线也有电阻(其值较小),电流通过时会发生电位降,所以两极之间在产生电流时的电位差,必小于不产生电流时的电位差,亦即必小于在平衡状态时两极的电位差。因此又称原电池的电动势为两极之间的最大电位差。
(2)原电池产生电流的机理。原电池产生电流,必须具备两个条件:两极之间存在电位差和构成电子流回路(或电流回路,但两者方向相反)。如铜锌电池中,由于两极之间存在电位差,即原电池电动势大于零,当导线接通时,电子即从负极(锌极)流出,因面破坏了平衡:
Zn⇔Zn²⁺+2e
使反应不断向右进行。电子通过导线到达正极(铜极),Cu²⁺获得电子成为Cu,同样也破坏了平衡:
Cu²⁺+e⇔Cu
使反应不断向右进行。即电池中进行着如下的反应:
Zn+Cu²⁺⇔Zn²⁺+Cu
由此可见,两极之间存在电位差(即原电池电动势大于零)时,原电池中就会自动进行氧化还原反应面产生电流。如果两极的电位相等或原电池的电动势等于零时,就不会起化学反应,也不发生电流。因此铜锌电池作用的极限,是两极的电位相等,这只有在Zn²⁺的浓度极高,Cu²⁺的浓度极低时才能达到。
原电池两极之间即使存在电位差,如果不构成电子流回路,同样不会发生电流。如铜锌电池的两极没有用导线相连,或是CuSO₄和ZnSO₄两溶液不相联通,离子不能发生迁移,电流是不会发生的。因此在两种溶液之间,采用一种特殊装置如素烧瓷或盐桥(见下面液体接界电位),既不使溶液混合,又可使明、阳离子发生迁移。如在用素烧瓷作隔膜的铜锌电池中,由于Cu²⁺成为Cu而使溶液中过剩的SO₄²⁻从CuSO₄溶液通过隔膜向ZnSO₄溶液迁移;与此相反,由于Zn成为Zn²⁺而过剩的Zn²⁺从ZnSO₄溶液通过隔膜向CuSO₄、溶液迁移,从而使两溶液都保持电中性。这样的离子迁移就相当于在溶液中电子从铜极流向锌极,构成一个在导线中电子从锌极到铜极,在溶液中电子从铜极到锌极的电子流回路。具备上述两个条件,原电池就在发生氧化还原反应的同时,产生电流。


























![硫酸亚铁铵标准溶液c[(NH4)2Fe(SO4)2]厂家价格](images/202207/thumb_img/1630_thumb_G_1658535105210.jpg)