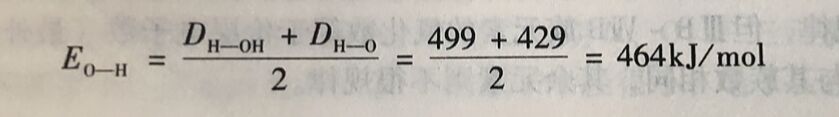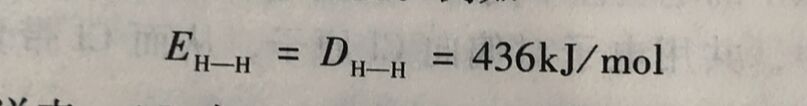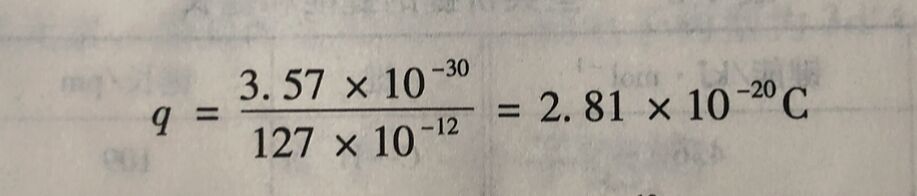这里需要注意,严格说来,ΔH表示的是键培面不是健能。键能是内能的部分,化学取应中旧键的断裂或新键的形成,都会引起系统内能的变化,所以应用内能的变化(ΔU)肉 示键能。但考虑到-般化学反应中体积功(pΔV)很小, 因此可用反应过程的焙变能的变化。
键能可通过光谱实验来测定 成利用标准生成焙的数据进行计算。键能越大,断裂该化学键 所需的能量越多,键越牢固。一些常见的共价键的键能和键长见表4-6。
表4-6 一些共价键的键能和键长
| 键 |
键长/pm |
键能/kJ·mol⁻¹
|
键 |
键长/pm |
键能/kJ·mol⁻¹ |
| H-H |
74 |
436 |
C-H |
109 |
414 |
| C-C |
154 |
347 |
C-N |
147 |
305 |
| C=C |
134 |
611 |
C-O |
143 |
360 |
C≡C
|
120 |
837 |
C=O |
121 |
736 |
| N-N |
145 |
159 |
C-CI |
177 |
326 |
| O-O |
148 |
142 |
N-H |
101 |
389 |
| CI-CI |
199 |
244 |
O-H |
96 |
464 |
| Br-Br |
228 |
192 |
S-H |
136 |
368 |
| I-I |
267 |
150 |
N≡N
|
110 |
946 |
| S-S |
205 |
264 |
|
|
|
4.2.1.2键长
分子内成键的两个原子核间的平衡距离,称为键长,用Lb表示,单位为pm。键长的数据可通过分子光谱实验或X衍射方法得到。部分常见的化学键的键长见表4-6。
由表4-6可以看出,两个确定的原子之间所形成的不同的化学键,其键长越短,键能越大,键越牢固。两个原子之间所形成的共价单键的键长等于两个原子的共价半径之和。例如: C-C、N-N、N-Cl键的键长分别是154pm、 145pm、 175pm, 则C-Cl键的键长约为Lbc-cl (Lbc-c +2Lbn-cl-Lbn-n)2= (154 +2x175-145)/2 = 179. 5pm。
4.2.1.3键角
分子中相邻的两个化学键的夹角,称作键角。NH,₃分子中N-H键夹角107°18',H₂O分子中O-H键夹角104°45'。键角可通过分子光谱实验或X衍射方法测定。键角和键长都是反映分子空间构型的重要因素,根据键长和键角数据,可推断分子的空间构型。例如S₈分子,实验测得Lhs-s=207pm,键角∠sss=105°,且8个S原子间两两间距都是207pm。由此推断S₈应是环状分子,若环在同一平面内,键角应为135°,所以环不在同一平面内,呈“八角绉环”
4.2.1.4偶极矩
当分子中成键的两个原子的电负性不同时,共用电子对将偏向电负性较大的一方,键具有了极性。例如,HCI分子中,共用电子对偏向Cl原子,从而CI带负电,H带正电,可以用H⁺⁸-Cl⁻⁸表示。
键的极性大小可以用偶极矩来衡量,用μ表示
μ=q·l
式中,q为电量; l为两个原子的核间距,即键长; μ的单位为C·m。偶极矩是矢量,方向是从正电荷指向负电荷。
偶极矩可由实验测得。例如,HCI 的偶极矩μ=3.57 x10⁻³⁰C· m,已知HCI的键长为127pm,由此可计算出
相当于0.18单位电荷(单位电荷的电量为1.602 x10⁻¹⁹C),即0. 18个单位电荷。也可以说,H-CI键具有18%的离子性。

































![硫酸亚铁铵标准溶液c[(NH4)2Fe(SO4)2]厂家价格](images/202207/thumb_img/1630_thumb_G_1658535105210.jpg)