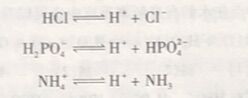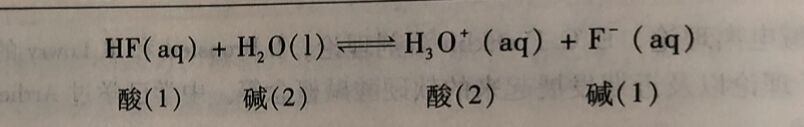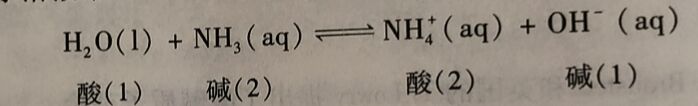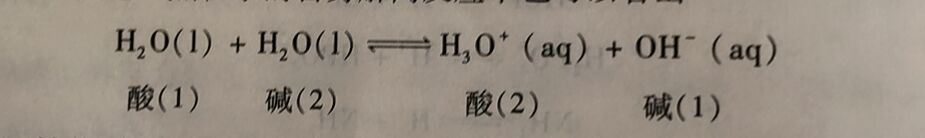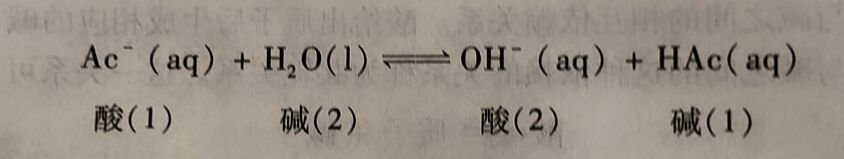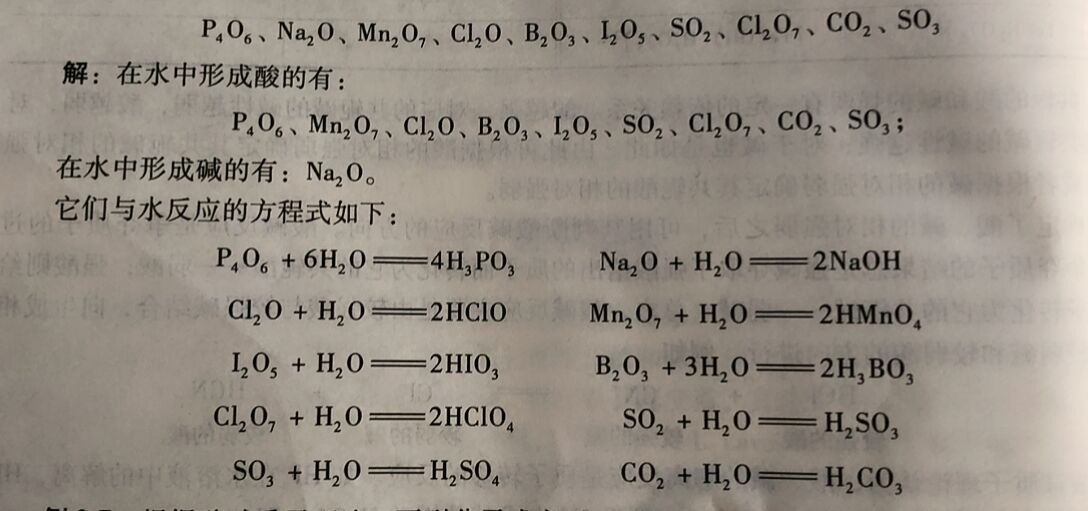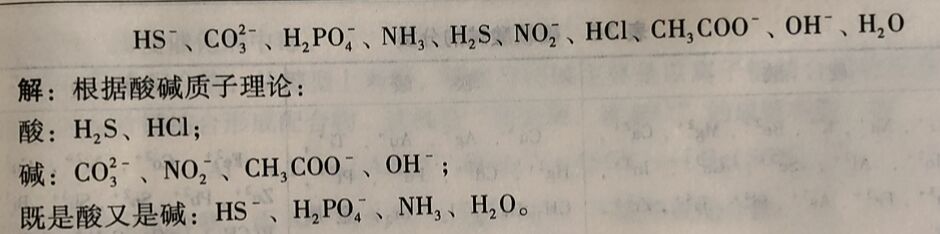人们对酸碱的认识经历了一个由浅人深,由低级到高级的认识过程。最初,人们对酸碱的认识只单纯地展于从物质所表现出来的性质上来区分酸和破。认为具有酸味、能使石蕊变为红色的物质是酸:面碱就是具有涩味、滑腻感,使红色石蕊变蓝,并能与酸反应生成盐和水的物质。后来,人们试图从物质的组成来定义酸碱。1787 年A. L Lavisier 提出了氧是酸的组成部 分: 1年,H.Dery又提出氢是酸的组成成分等等。这些酸碱概念都有局限性。随着生产和科学技术的进步,人们的认识不断深化,提出了多种酸碱理论。其中比较重要的有s.A Amheis酸碱电离理论,E c Fanklin溶剂理论,J.Brnsted和T. Lowry的酸碱质子理论, G.N. Lewis的电子理论以及近期发展起来的软硬酸碱概念等。中学已学过Anthenius 酸碱电离理论,这里不再赘述。
1923年,丹麦的J.Bronsted 和英国的T. Lowry提出了酸碱质子理论。
HCl、H₂PO₄⁻、NH₄⁺都能给出质子,它们都是酸。NH₃、CI⁻、HPO²₄⁻都可以接受质子,都是碱。
质子理论强调酸与碱之间的相互依赖关系。酸给出质子后生成相应的碱,而碱结合质子后又生成相应的酸,酸与碱之间的这种依赖的关系称为共轭关系。这关系可以用通式表示
酸给出一个质子后生 成的碱称为这种酸的共轭碱,例如NH, 是NH₄⁺的共轭碱;碱接受个质子后所生成的酸称为这种碱的共轭酸,例如NH₄⁺是NH₄⁺的共轭酸。酸与它的共轭碱(或 碱与它的共轭酸) 一起被称为共轭酸碱对。
共轭的酸和碱的强弱有一定的依赖关系。酸越强,对应的共轭碱的碱性越弱,酸越弱,对应的共轭碱的碱性越强;对于碱也是如此。由此可根据酸的相对强弱确定其共轭碱的相对强弱,或者根据碱的相对强弱确定其共轭酸的相对强弱。
确定了酸、碱的相对强弱之后,可用其判断酸碱反应的方向。酸碱反应是争夺质子的过 程,争夺质子的结果总是强碱夺取了强酸给出的质子面转化为它的共轭酸弱酸; 强酸则给 出质子转化为它的共轭碱一弱碱。 总之,酸碱反应主要是由较强酸与较强碱结合,向生成相应的较弱碱和较弱酸的方向进行。例如
酸碱质子理论认为,酸、碱的解离反应是质子转移的反应。如HF在水溶液中的解离,HF给出H⁺后,生成其共轭碱F⁻;而H₂O接受日H⁺生成其共轭酸H₃O⁺,即
同样,NH₃在水常波中的解离反应也是质子转移反应,可表示为
由上可见,在酸的解离反应中,H₂O是质子的接受体,H₂O是碱;在碱的解离反应中,H₂O是质子的给予体,H₂O又是酸。这种既能给出质子又能接受质子的物质被称为两性物质。水就是两性物质之.,这一点在水的自身解离反应中也可以看出
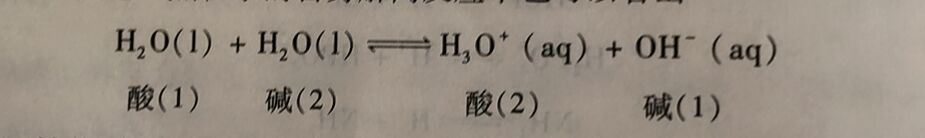
其他常见的两性物质还有HSO₄⁻、H₂PO₄⁻、HPO₄²⁻、 HCO₃⁻等。
Arrhenius电离理论中的盐类水解反应实际上也是酸碱的质子转移反应。例如,NaAc 的水解反应
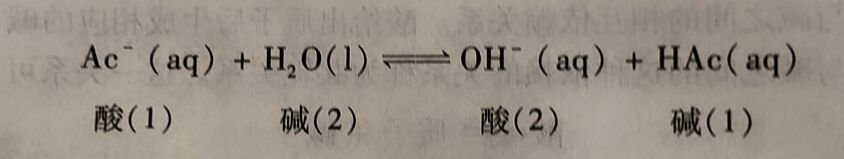
Ac⁻与H₂O之间发生了质子转移反应,生成了HAc和OH⁻
质子理论不仅适用于水溶液中的酸碱反应,同样适用于气相和非水溶液中的酸碱反应。 如: HCI与NH₃的反应,无论在水中,还是在气相中或是有机溶剂中,其实质都是质子转移反应,最终生成氯化铵。因此均可表示为
酸碱质子理论扩大了酸和碱的范畴,使人们加深了对酸碱的认识。但是,质子理论也有局限性。它只限于质子的给予和接受,对于无质子参与的酸碱反应就无能为力了。
例2-6下列氧化物哪些在水中形成酸, 哪些在水中形成碱,分别写出它们与水的反应方程式。
例2-7 根都酸碱质于理论,下列分子皮离子那些是酸?哪此是碱?哪些既是酸又是碱?
2.2.2酸碱电子理论
在酸碱质子理论提出的同一年,美国化学家G. N. Lewis提出了酸碱电子理论。
该理论的基本要点是,酸是任何可以接受电子对的分子或离子物种,酸是电子对的接受体,必须具有可以接受电子对的空轨道。碱则是可以给出电子对的分子或离子物种,碱是电子对的给予体,必须具有未共享的孤对电子。酸碱之间以共价配键相结合。
Lewis 的酸碱电子理论的适用范围更广泛。例如,H⁺与OH⁻反应生成H₂O,这是典型的Arrhenius电离理论的酸碱中和反应。质子理论也能说明H⁺是酸,OH⁻是碱。根据酸碱电子理论,OH⁻具有孤对电子,能给出电子对,它是碱;而H⁺有空轨道,可接受电子对,是酸; H⁺ 与OH⁻反应生成含配位键的酸碱加合物 H₂O。
在气相中氯化氢与氨反应生成氧化铵。这一反应既可用质子理论解释,也可用电子理论解 释。按照电子理论,NH₃中N上的孤对电子提供给HCI中的H (指定原来HCI的H—Cl 键的共 用电子对完全属于Cl之后,H有了空轨道),形成NH₄⁺中的配位共价键[H₃N→H]⁺。
碱性氧化物Na₂O与酸性氧化物SO₃反应生成盐Na₂SO₄该反应也是酸碱反应。然而,该反应不能用质子理论说明。但根据酸碱电子理论,Na₂O中的O²⁻具有孤对电子, 是碱; SO₃中S能提供空轨道接受孤对电子,是酸: Na₂O与SO₃反应生成含配位键的酸 碱加合物Na₂SO₄。B( OH)₃,与水反应并不是给出它自身的质子,而是B (有空轨道)接受 了H₂O的OH⁻ : 中O²⁻提供的孤对电子形成B(OH)₄⁻,因此,硼酸H₃BO₃不是质子酸,而是Lewis酸。
Lewis 酸碱的范围很广泛,许多配合物和有机化合物都是Lewis酸碱的加合物。但是酸碱电子理论也不是完美无瑕的,其缺点是不易确定酸碱的强度。