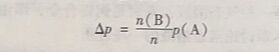稀溶液的通性
铜臭 / 2022-07-11
溶液是由两种或两种以上物质构成的均匀而稳定的系统。溶液也有不同的聚集状态,有气 态、液态和固态溶液。空气是一 种气态溶液,青铜是钢锡合金,即由钢和锡构成的固体溶液。液态溶液是最常见的溶液。本章讨论液态溶液的一些性质。
溶液为混合物,成分有溶剂和溶质。-般来讲,量多的组分为溶剂。对于含水的溶液,通常以水为溶剂。
溶液的物理和化学性质与溶质和容剂有关,组成不同的溶液性质也不同。但稀溶液有一一些性质,与溶剂的本质有关,与溶质的量(质点数)有关,而与溶质的本质无关。与纯溶剂相比,溶液的蒸气压下降、沸点升高、凝固点降低以及落液具有渗透压。这些性质只与溶液中溶质的数量有关而与溶质的本性无关,这些性质称为稀溶液的依数性(有时称为通性)。
溶液的通性,在这里只扼要讨论由不同的难挥发性溶质B和溶剂A组成的溶液都会引起溶液的蒸气压下降、沸点上升和凝固点下降,以及溶液渗透压等。工业上应用的干燥剂、抗凝刊、冷冻剂以及反渗透技术都与这些性质有关。
2.1.1蒸气压下降
如果把一杯液体(如水)置于密闭的容器中,液面上那些能量较大的分子就会克服液体分子间的引力从表面逸出,成为蒸气分子,这个过程叫做蒸发。相反,蒸发出来的某些蒸气分子在液面上的空间运动时可能撞到液面,被液体分子所俘获而重新进人液体中,这个过程叫做 凝聚。凝聚过程是放热过程,同时系统的熵值也减小。在-定的温度下, 液体的蒸发速率是恒定的。蒸发刚开始时,蒸气分子不多,凝聚的速率远小于蒸发的速率。随着蒸发的进行,蒸气浓度逐渐增大,凝聚的速率也随之增大。当凝聚的速率和蒸发的速率达到相等时,液体和它的蒸气就处于平衡状态,此时,燕气所具有的压力称作该温度下液体的饱和蒸气压,简称蒸气压。
以水为例,在一定温度下达到如下相平衡时

H₂O(g)所具有的压力p(H₂O)即为该温度下的蒸气压。例如100°C时,p(H₂O) = 100kPa。
日常生活中可以看到,在严寒的冬季里,晾洗的衣服上的冰可以逐渐消失,不经融化也可以逐渐减小乃至消失,面樟脑丸在常温下逐渐挥发。这些现象都说明固体表面的分子也能蒸发。如果把固体放在密封的容器内,固体和它的蒸气之间也能达成平衡,此时固体具有一-定的蒸气压。固体和液体的蒸气压都随温度的升高而增大。
由于难挥发的溶质的蒸气压很小,与溶剂的蒸气压相比可忽略不计。当溶剂溶解了难挥发的溶质后,溶剂的一部分表面或多或少地被溶质的微粒所占据,从而使得单位时间内从溶液中蒸发出的溶剂分子数比原来从纯溶剂中蒸发出的分子数要少,溶剂的蒸发速率变小。纯溶剂气相与液相之间原来平衡的蒸发与凝聚两个过程,在加人难挥发溶质后,由于溶剂蒸发速率的减小,使凝聚占了优势,结果使系统在较低的蒸气浓度或压力下,溶剂的蒸气(气相)与溶剂(液相)建立平衡。因此,在达到平衡时,难挥发溶质的溶液中溶剂的蒸气压力低于纯溶剂的 蒸气压力。在这里,所谓溶液的蒸气压力实际是指溶液中溶剂的蒸气压力( 因为溶质是难挥发的,其蒸气压可忽略不计)。同一温度下,纯溶剂蒸气压力与溶液蒸气压力之差称作溶液的蒸气压下降。显然,溶液的浓度越大,溶液的蒸气压下降越多。
实验结果表明,在一定温度时, 对于难挥发的非电解质稀溶液,其蒸气压下降值( Δp)与溶质的物质的量分数成正比。其数学表达式为
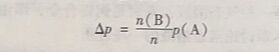
式中,n(B)表示溶质B的物质的量: n(B)/n表示溶质B的物质的量分数; p(A)表示纯溶剂A的蒸气压。
例2-1 25°C, 17.1g蔗糖溶于100g水。计算该溶液的蒸气压(蔗糖相对分子质量342.3,水的蒸气压2338Pa)。

2.1.2沸点上升和凝固点下降
当某一液体的燕气压力等于外界压力时,液体就会沸腾,此时的温度称为该液体的沸点。面某物质的爱固点(成格点)是该物质的液相流气压力和国和乐气压力相等时的温度。
一切可形成晶体的纯物质,在给定条件下,都有定的凝固点和沸点。但溶液的情况并非如此,一般由于溶质的加人会使溶剂的凝固点下降、溶液的沸点上升。而且溶液越浓,凝固点和沸点改变越大。
溶液蒸气压下降会导致溶液沸点上升和凝固点下降。现在通过水溶液的例子来说明这个问题。以蒸气压力为纵坐标,温度为横坐标,画出纯水和冰的蒸气压力曲线,如图2-1 所示。
水在正常沸点(100°C 即373.15K)时其蒸气压力恰好等于外界压力(100kPa)。 如果水中溶解了难挥发性的溶质,其蒸气压力就要下降。因此,溶液中溶剂的蒸气压力曲线就低于纯水的蒸气压力曲线,在373.15K时溶液的蒸气压力就低于100kPa。要使溶液的压力与外界压力相等,就必须把溶液的温度升到373.15K以上。
从图2-1中可见,溶液的沸点(T'b)比水的沸点(Tb)高,其差值ΔTb为沸点升高值。从图中还可以看到,在温度T,(273.15K) 时,冰的蒸气压力曲线和水的蒸气压力曲线相交于一点(O),此时冰的蒸气压力和水的蒸气压力相等,均为611Pa。由于溶质的加人使溶液的蒸气压力下降。这里必须注意到,溶质是溶于水中而不溶于冰中,因此只影响水的蒸气压力,对冰的蒸气压力没有影响。在273.15K时,溶液的 蒸气压力必定低于冰的蒸气压力,冰与溶液不能共存,冰要转化为水,所以溶液在273. 15K时 不能结冰。在273. 15K以下某一温度(T'f)时,冰的蒸气压力曲线与溶液的溶剂蒸气压力曲 线可以相交于一点(O'), T'f是溶液的凝固点。它比纯水的凝固点要低ΔTf(凝固点下降值)。
对于难挥发的非电解质稀溶液,其沸点上升和凝固点下降与溶液的质量摩尔浓度( 所谓质量摩尔浓度m是指1kg溶剂中所含溶质的物质的量)成正比,可用下列数学式表示
表2-1 一些溶剂的沸点上升和溶剂的凝固点下降常数
| 溶剂 |
沸点/°C |
kb/K.kg.mol’⁻¹
|
凝固点/°C
|
kf/K.kg.mol’⁻¹ |
| 醋酸 |
117.9 |
2.530 |
16.66 |
3.90 |
| 笨 |
80.100 |
2.53 |
5.533 |
5.12 |
| 氯仿 |
61.150 |
3.62 |
—— |
—— |
| 萘 |
217.955 |
5.80 |
80.29 |
6.94 |
| 水 |
100.00 |
0.515 |
0.0 |
1.853 |