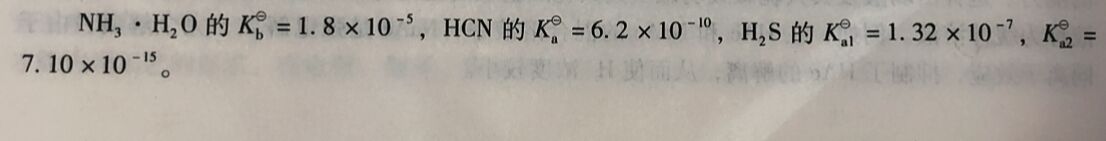在常温(18-25°C) 时,K=1.0x10⁻¹⁴。纯水中H⁺浓度和OH⁻浓度相等,呈中性。如H⁺浓度大于OH⁻浓度,呈酸性,反之呈碱性。生产和科学实验中常用pH值表示溶液的酸碱性。
pH=7,溶液为中性; pH>7,溶液呈碱性; pH<7, 溶液呈酸性。粗略测定溶液的pH 值,可用pH试纸。 精确测定时,要用pH计。一些常见的液体都具有一定范围的 pH值范围,如表2-4所示。
表2-4 一些常见液体的pH值
| 液体 |
柠檬汁 |
酒 |
醋 |
番茄汁 |
人尿 |
牛奶 |
人唾液 |
饮用水 |
人血液 |
海水 |
| pH值 |
2.2~2.4 |
2.8~3.8
|
3.0 |
约3.5 |
4.8~8.4 |
6.3~6.6 |
6.5~7.5 |
6.5~8.0 |
7.3~7.5 |
约8.3 |
2.3.1.2弱酸弱碱的解离 平衡
弱酸HAc在水中存在如下解离平衡:
HAc(aq)⇔H⁺(aq) + Ac⁻(aq)
2.3.1.3电离度和稀释定律
电离度是弱电解质达到解离平衡时,已解离的浓度与起始浓度的比值,用α表示。
电离度大小可以表示弱电解质的相对强弱。电离度除和电解质的本性有关外,还和溶液的浓度、温度有关。
电离度和解离常数之间存在着一定的关系。
弱电解质AB的解离常数为K,电离度为α,起始浓度为c,则
式(2-11) 表明弱电解质溶液的浓度、电离度和解离常数之间的关系。在一定温度下,弱电解质的电离度a随其浓度的减小面增大,这个关系式称作稀释定律。
一元弱电解质电离 出来的离子浓度为
任何共轭酸碱的解离常数之间都有同样的关系,即.jpg) 互成反比,这体现了 共轭酸碱之间的强度的关系,酸越强,其共轭碱越弱,强酸(如HCl、 HNO₃)的共轭碱 (Cl⁻、NO₃⁻) 碱性极弱,可认为是中性的。根据前面关系式,也可看出,只要知道共轭酸碱中酸的解离常数Ka,便可算出其共轭碱的解离常数,或已知碱的解离常数Kb,便可算出其共 轭酸的解离常数Ka。例如,已知HAc的Ka=1.74x10⁻⁵,则Ac⁻的Kb为:Kb=5.75x10⁻¹⁰。
互成反比,这体现了 共轭酸碱之间的强度的关系,酸越强,其共轭碱越弱,强酸(如HCl、 HNO₃)的共轭碱 (Cl⁻、NO₃⁻) 碱性极弱,可认为是中性的。根据前面关系式,也可看出,只要知道共轭酸碱中酸的解离常数Ka,便可算出其共轭碱的解离常数,或已知碱的解离常数Kb,便可算出其共 轭酸的解离常数Ka。例如,已知HAc的Ka=1.74x10⁻⁵,则Ac⁻的Kb为:Kb=5.75x10⁻¹⁰。
2.3.2多元弱酸的解离平衡
多元弱酸的解离是分级进行的,每级都对应一个解离平衡, 都有一个解离常数。以氢硫 酸H₂S为例,其解离过程按以下两级进行
H₂S二级解离的解离常数比级解离常数要小得多, 
计算溶液中H⁺浓度时,由于多元弱酸大多 一般可忽略二级解离平衡, 与计算一元弱酸H⁺浓度的方法相同。
一般可忽略二级解离平衡, 与计算一元弱酸H⁺浓度的方法相同。
例2-10计算在0.10mol/dm³ H₂S溶液中的H⁺、S²⁻浓度及pH值。
从以上计算可知,对于二元弱酸溶液,其负二价酸根离子的浓度在数值上等于二级解离常数。该结论仅适用于纯的二元弱酸溶液。
例2-11计算下列盐溶液的 pH值:
(1) 0.10mol/dm³NaCN溶液;
(2) 0. 01mol/dm³Na₂S溶液。
2.3.3缓冲溶液
2.3.3.1同离子效应
与所有的化学平衡-样,当溶液的浓度、温度等条件改变时,弱酸、弱碱的解离平衡会发生移动。在弱酸或弱碱溶液中加人与它们具有相同离子的强电解质时,使得弱电解质的解离度 降低,这种现象称为同离子效应。在0. 10mol/dm³HAc溶液中,加入NaAc晶体,使得NaAc浓 度为0.10mol/dm³时,α(HAe)只有0.018%,与未加人NaAc晶体时a(HAe) = 1.3% (例2-8 的结果)相比,HAc的解离度大大降低了,这就是同离子效应的结果。
2.3.3.2缓冲溶液
由弱酸及其共轭碱或弱碱及其共轭酸组成的溶液具有- 种很重要的性质,其pH值能在一定范围内不因稀释或外加少量的酸和碱而发生显著变化。也就是说,对外加的酸和碱具有缓冲的能力。这种由弱酸及其共轭碱或弱碱及其共轭酸组成的且对外来的酸和碱具有缓冲作用的溶 液称为缓冲溶液。例如,在HAc和NaAc的混合溶液中,NaAc 是强电解质,完全解离,由于同离子效应,抑制了HAc的解离,从而使H浓度较小。


















































.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)