离子液中的酶催化反应一一酯交换反应
化学先生 / 2019-08-06
在离子液中进行的酶催化酯交换反应,主要是用于外消旋体的动力学拆分。实验证明,在离子液体中进行酯交换反应,酶表现出良好的稳定性,而且立体选择性也比传统有机溶剂高。分离后离子液可以重复使用,未发现酶的活性和对映体选择性降低。
2002年Susheel.J. Nara等在离子液和有机溶剂共存下,进行脂肪酶催化的酯交换反应发现,将离子液[BMIm][PF6]添加到有机溶剂中,当加入量为0~ 90%(体积分数)时,反应的初始速率逐渐增加。采用不同离子液[BMIm][PF6]、CH2Cl2 和[BMIm][BF4]等,将Pseudomonas cepacia PS-D脂肪酶固定于小颗粒硅藻土上和游离酶进行对比试验表明,固定化酶反应初活性的顺序为[BMIm][PF6]> [BMIm][BF4]> CH2Cl2,这可能与离子液的亲水性有关,用无水的[BMIm][BF.]进行试验,酶的活性会很快降低,可能是[BMImJ[BF4]夺去了酶本身保持分子刚性的必需水,从而导致了酶的失活。
用游离的PS-D脂肪酶进行同样试验发现,反应的初始速率顺序是[BMIm][PF6]>CH2Cl2>[BMIm][BF4],这是由于固定化酶的刚性结构不像游离酶那样易受溶剂化效应的影响。并且在此反应体系中,减压除去乙酸乙烯酯后,再用乙醚提取产物,所剩的含酶离子液体,重复使用5次酶活性没有明显下降。这说明,在固定化脂肪酶催化酯交换反应体系中,采用适当的离子液体代替有机溶剂,可以保持酶的活性和稳定性。这样,不但有利于酶和产物的分离以及酶的重复使用,而且可以减少有机溶剂对环境的污染。
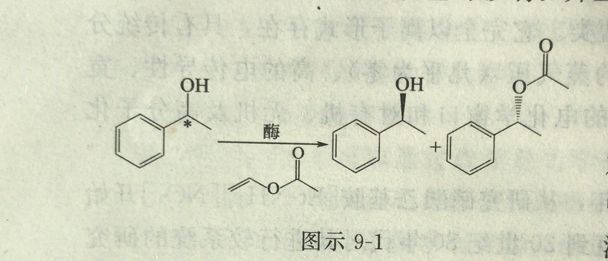
2003年Pedro Lozano报道了在10MPa、150摄氏度的极端条件下,超临界CO2和[ EMIm][Tf2N]、[BMIm][Tf2N]离子液介质中,用固定化和未固定化的南极酵母脂肪酶B(Candida antarctica lipase B)连续拆分外消旋苯基乙醇的反应(图示9-1) 证明,脂肪酶在无水的极端条件下,同样具有极好的催化活性、稳定性和立体选择性。离子液和超临界CO2结合作为酶催化反应介质,在绿色催化合成工艺中具有良好的应用潜力。