在不同能级中电子所占的轨道的大小、形状和在空间中的方向是彼此不同的。主层的量子数越大,相应轨道的体积便越大。举例来说,28.电子的轨道比1s电子的轨道有较大的体积,而38电子的轨道比2s电子的轨道有较大的体积。不过应该注意,较高主层的一些轨道能够和较低主层的一些轨道发生交错,这表明外层电子能够穿透到内层电子所占的区域里去。
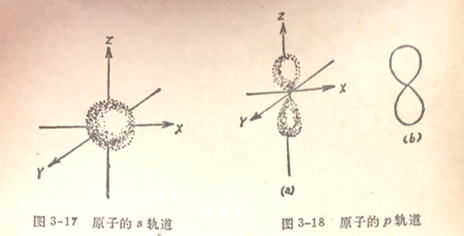
关于轨道的形状,s轨道是球形的(图3-17),而2轨道是种有两个结包的哑铃形的(图3-18a)或它的截面是一个8字形的(图3-18b)。
原子軌道在空间可能伸展方向的数目取决于轨道形状。不管一个球体(8轨道)怎样取向对一个外界观察者来说它的外观仍然是一样的。因此我们说8型轨道是球形对称的和没有方向的。对于轨道来说情况就变得比较复杂,它出现为一组3个轨道。虽然不可能确定给定的一组p轨道中任何一个的方向。但是3个2轨道的轴(以原子核处在轴的交点上)彼此互成直角(图3-19)。有如图中所示,这三个P轨道用2=,py和?っ来标志,借以指出它们的方向性。
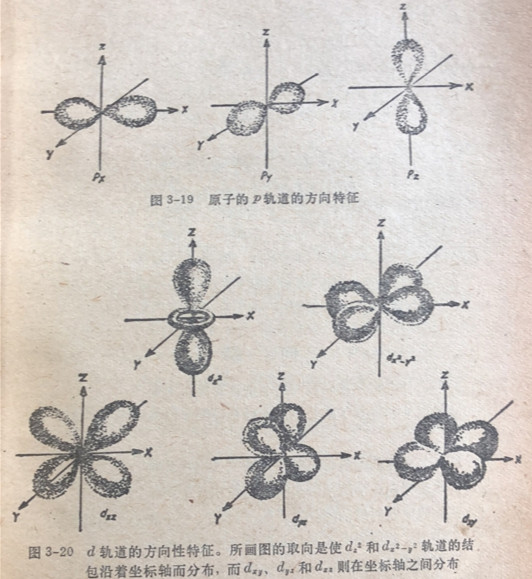
五个d轨道各由结结包形的区域组成,它们在空间的排布有如图3-20所示,这些轨道将在配位化合物一章(第三十二章)中详加讨论。
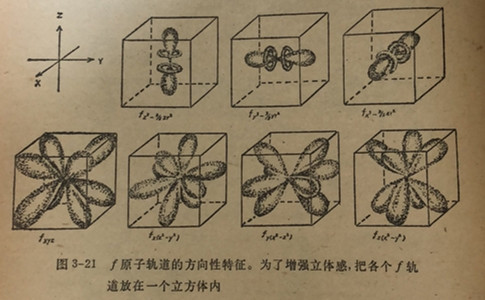
对于如何表示7个f轨道的问题,并没有如同8、p和以轨道那样有很好的一致意见。图3-21绘示了代表了轨道的一种方式。把各轨道绘示在一个立方体内借以帮助读者看到这种表示方法的三维立体外貌。