


















用类似于制硅烷的方法已制得二十多种硼的氢化物——硼烷。硼烷在组成上与硅烷、烷烃相似,而在物理、化学性状方面更像硅烷(见表14-8)。
表14-8 碳、硅、硼的氢化物的物理性质的比较
| 硼烷 | 烷烃 | 硅烷 | ||||||
| 化合物 | 熔点/K | 沸点/K | 化合物 | 熔点/K | 沸点/K | 化合物 | 熔点/K | 沸点/K |
| CH4 | 90 | 110 | SiH4 | 88 | 161 | |||
| B2H6 | 107.5 | 180.5 | C2H6 | 101 | 184.7 | Si2H6 | 141 | 258 |
| C3H8 | 83 | 228 | Si3H8 | 156 | 326 | |||
| B4H10 | 153 | 291 | C4H10 | 148 | 272.5 | Si4H10 | 189 | 380 |
| B5H9 | 226.4 | 321 | C5H12 | 141 | 309.2 | Si5H12 | >373 | |
| B5H11 | 150 | 336 | C6H14 | 178.7 | 342 | Si6H14 | >373 | |
| B6H10 | 210.7 | 383 | ||||||
| C7H16 | 183.0 | 371.4 | ||||||
| B10H14 | 372.6 | 486 | C10H22 | 241 | 447 | |||
硼烷有BnHn+4和BnHn+6两大类,前者较稳定。在常温下,B2H6及B4H10为气体,B5~B8为液体,B10H14及其它高硼烷都是固体。高硼烷都可以看作是不完整的二十面体碎片(见图14-9)。
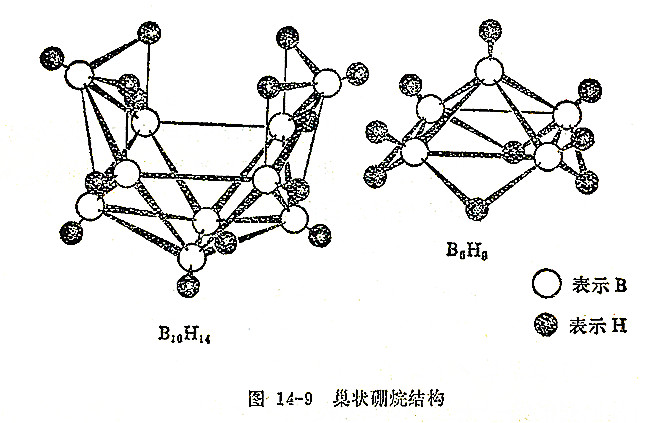
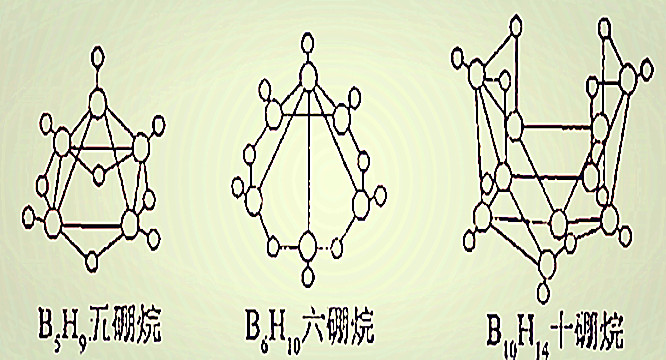
表14-9 常见的硼烷
| 分子式 | B2H6 | B4H10 | B5H9 | B5H11 | B6H10 | B10H14 |
| 名称 | 乙硼烷 | 丁硼烷 | 戊硼烷-9 | 戊硼烷-11 | 己硼烷 | 癸硼烷 |
| 室温下状态 | 气体 | 气体 | 液体 | 液体 | 液体 | 固体 |
| 沸点/K | 180.5 | 291 | 321 | 336 | 383 | 486 |
| 熔点/K | 107.5 | 153 | 226.4 | 150 | 210.7 | 372.6 |
| 溶解情况 | 易溶于乙醚 | 易溶于苯 | 易溶于苯 | 易溶于苯 | 易溶于苯 | |
| 水解情况 | 室温下很快 | 室温下缓慢 | 363K 三天尚未水解完全 | 363K时16小时尚未水解完全 | 室温缓慢加热较快 | |
| 稳定性 | 373K以下稳定 | 不稳定 | 很稳定 | 室温分解 | 室温缓慢分解 | 极稳定 |
硼烷多数有毒、有气味、不稳定。在空气中激烈地燃烧且放出大量的热。
B2H6+3O2=(燃烧)B2O3+3H2O △H°=-2166kJ·mol-1
它们是强还原剂,能与氧化剂反应。与卤素生成卤化硼:
B2H6+6X2=2BX3+6HX
硼烷水解放出H2:
B2H6+6H2O=2H3BO3↓+6H2↑
有些硼烷加热即分解,如乙硼烷只在373K以下稳定,高于此温度,则转变为高硼烷。B2H6的热分解产物很复杂,有B4H10、B5H9、B5H11和B10H14等等,控制不同条件,可得到不同的主产物。
如:2B2H6=(加压)B4H10+H2
相当于CH4和SiH4的BH3只能瞬时存在。在一般制备反应中得到的是BH3的二聚体B2H6。
4BF3+3NaBH4=(乙醚或其它非羟基溶剂)2B2H6+3NaBF4
B2H6是制纯硼或其他硼化合物的原料之一。也是p型半导体材料的掺杂剂(BF3也是)。
