

















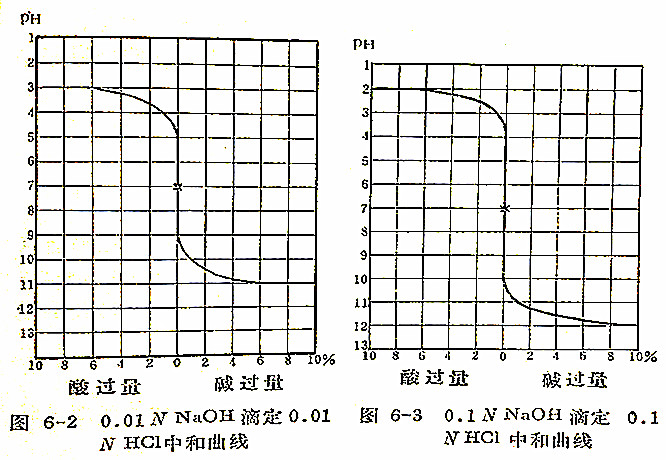
滴定时指示剂的选择,要根据被潮定物质的中和曲线。原则上,应选择一种指示剂,其变色范围能包括滴定时等当点的pH在内,或者在等当点的pH值左右一定范围内,能包括所选指示剂的变色范围。强酸强碱滴定时等当点的pH是7,所以任何在此点或靠近此点而变色的指示剂都可采用。例如,用0.01N的碱滴定0.01N的酸,在等当点前酸剩余量在原量0.1%时的pH值等于5,在等当点后滴入的碱过量0.1%时的pH值等于9。图6-2所示即为用0.01N NaOH溶液滴定0.01N HCl溶液的中和曲线。
从图6-2中看出,当pH在5~9时的线段似乎全在等当点上。因此,凡是变色范围的pH值为5~9的指示剂都可以采用。如果滴定0.1N溶液,其相应的pH范围就扩大为4~10(图6-3),可选用的指示剂就更多。
但在酸碱滴定反应中,因所生成的盐类水解情况不同,致使终点时溶液的pH值很多不在7。因此,就需要了解各类盐的水解情况,便于选择适当的指示剂,使滴定终点尽量与反应的等当点一致。
当中和反应进行到等当点附近时,加入一滴酸或碱,将使溶液的pH值发生一个由量变到质变的急剧变化。这种pH值的急剧改变称为滴定突跃。滴定反应中溶液pH值的突跃范围,即是中和曲线上的终点线段(即图6-2中的pH5~9线段),所以是指示剂选择的主要根据。当然,最理想的指示剂应该恰好在等当点时变色,但任何事物没有是绝对的,实际上很难找到一种指示剂恰好在等当点时变色。因此,只要变色点在pH值突跃范围以内的指示剂都可以认为比较适合应用。下面分别讨论用0.1N的酸、碱溶液滴定的几种情况下应该选择的指示剂。

(1)强酸滴定强碱(或强碱滴定强酸)
因为由强酸和强碱反应后所生成的盐不水解,如NaCl、Na2SO4、KNO3等。因而在等当点时,溶液的pH值等于7。滴定的突跃范围的pH值在4.3~9.7。所以强酸(碱)滴定强碱(酸)时的指示剂可以选用甲基橙、甲基红、石蕊、中性红、酚酞等任何一种。
(2)强酸滴定弱碱(或弱碱滴定强酸)
由强酸和弱碱反应后所生成的盐能够水解,例如用HCl滴定NH4OH时的反应:
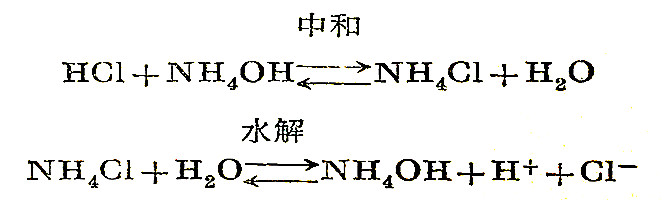
因此,当达到等当点时,使溶液呈酸性反应。在等当点时溶液的pH值是5.3,滴定突跃范围发生在PH6.3~4.3之间。所以,指示剂可选用甲基橙、甲基红,而酚酞和中性红不适于使用。
(3)强碱滴定弱酸(或弱酸滴定强碱)
强碱和弱酸反应后所生成的盐水解以后,会使溶液呈碱性,例如,用NaOH滴定HAC(醋酸)时的反应:
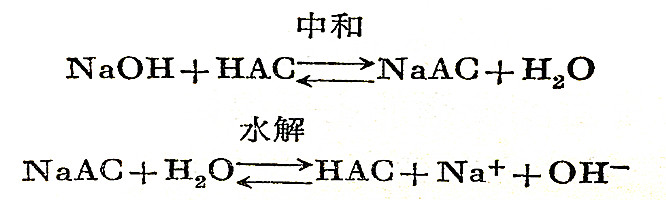
在达到等当点时,溶液的pH值为8.7,滴定的pH值突跃范围发生在7.7~9.7,指示剂可选用酚酞或中性红,而甲基橙和甲基红不宜使用。
(4)弱酸盐与弱碱盐的滴定
呈弱酸性的盐在溶液中如遇到氢离子时,弱酸盐的酸根阴离子就会与氢离子结合生成不易电离的弱酸,逐渐使溶液中的氢离子减少。所以,用标准酸溶液滴定弱酸盐,当达到等当点时,一滴标准酸就可以使溶液的pH值发生急剧地变化。因此,可以选择在此pH值范围内的指示剂来指示反应的等当点。
对于这一类的滴定,所生成的弱酸其电离常数越小(在溶液中离解出的氢离子浓度越低)越好。电离常数较大的弱酸,如醋酸K=1.86×10(-5次方),其钠盐即不能用HCl直接滴定。因为滴定到等当点时,pH值的突跃范围不明显。但碳酸H2CO3,虽有两个氢离子,而它的一、二级电离常数却都很小,K1=4.3×10(-7次方),K2=5.6×10(-11次方)。因此Na2CO3可以用HCl来滴定。Na2CO3与HCl的反应分两步进行:
Na2CO3+HCl → NaHCO3+NaCl
NaHCO3+HCl → NaCl+H2O+CO2↑
当第一个反应进行至等当点时,溶液的pH值为8.3,可以用酚酞作指示剂;当反应进行至第二个等当点时,溶液的pH值为3.9,在这点的附近也有一个pH值突跃范围,可选用甲基橙作指示剂。
极弱的弱碱盐,与上述情况相似,可用NaOH溶液进行滴定。
综上所述,各种滴定条件下所选用的指示剂,以表6-3概括。
表6-3 中和法常用指示剂
| 酸 | 碱 | 选用指示剂 |
在该pH时溶液的颜色 小于变色范围下限 |
在该pH时溶液的颜色 大于变色范围上限 |
| 强 | 强 |
甲基红 甲基橙 中性红 酚酞 |
红 红 红 无 |
黄 橙黄 黄 紫红 |
| 弱 | 强 | 酚酞 | 无 | 紫红 |
| 强 | 弱 |
甲基橙 甲基红 |
红 红 |
橙黄 黄 |
| 弱酸盐(如Na2CO3) | 用HCl滴定 |
(1级)酚酞 (2级)甲基橙 |
无 红 |
紫红 橙黄 |
| 弱碱盐(如NH4OH) | 用NaOH滴定 | 甲基橙 | 红 | 橙黄 |