
之前文章介绍了浓度、温度、催化剂剂等外界条件对反应速率的影响,为什么这些条件的改变能影响反应速率呢?下面将简单讨论反应速率的碰撞理论和活化配合物理论。
碰撞理论
碰撞理论是以分子运动论为基础的。碰撞理论认为:任何化学反应的发生其必要条件是反应物分子相互碰撞,反应速率与反应物分子间的碰撞频率有关。根据气体分子运动论的计算表明,单位时间内分子间的碰撞次数是很大的。在标准状态下,每秒钟每升体积分子间的碰撞可达1032次或更多。碰撞频率如此之大,显然不可能每次碰撞都发生反应,否则所有的反应将会在瞬间完成。
实际上,在无数次的碰撞中,大多数碰撞并不导致反应的发生,只有少数分子间的碰撞才能发生化学反应。能发生化学反应的碰撞称为有效碰撞。能发生有效碰撞的分子称为活化分子。活化分子与普通分子的主要差别在于它们具有不同的能量,见图1-1、图1-2。
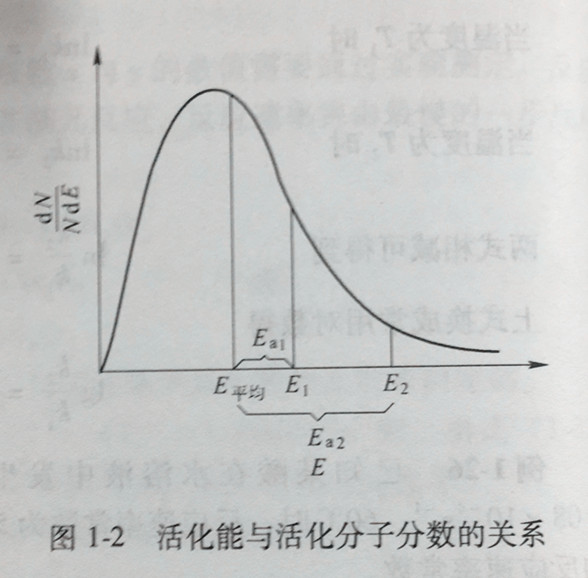
图1-1所示的是在一定温度下分子能量的分布情况。图中横坐标为能量,纵坐标是单位能量范围内的分子分数,E平均表示在该温度下分子的平均能量。由图1-1可见,具有很低能量或很高能量的分子都很少,大部分分子的能量接近于平均值。只有当两个相碰撞的反应物分子的能量等于或大于某一特定的能量值E最低时,才有可能发生有效碰撞,这种具有等于或大于E最低能量的分子称作活化分子。E最低即为活化分子具有的最低能量。图中阴影部分的面积表示活化分子的分子分数。活化分子具有的最低能量与分子的平均能量之差(E最低-E平均)就称为反应的活化能。
每一个反应都有其特有的活化能。从图1-2可以看出,若反应的活化能越大,E最低在图中横坐标的位置就越靠右右,对应曲线下的面积就越小,活化分子分数就越小,单位时间内有效碰撞的次数越少,反应速率也就越慢。反之,活化能越小,反应速率就越快。一般化学反应的活化能约在40~400kJ/mol之间。活化能小于40kJ/mol的反应,反应速率很快,可瞬间进行,如中和反应等。
在讨论化学反应的快慢时,除了考虑分子的碰撞频率和活化能以外,还要考虑分子的碰撞方位。即反应物分子碰撞而起反应,它们彼此间的取向必须适当。
活化配合物理论
活化配合物理论又称为过渡状态理论。该理论认为,反应物分子要发生碰撞而相互靠近到定程度时,分子所具有的动能转变为分子间相互作用的势能,系统的势能增加。分子中原子间的距离发生了变化,I旧键被削弱,同时新键开始形成。这时形成了活化配合物,见图1-3。
图1-3中E1表示反应物分子的平均能量,E2表示产物分子的平均能量,E3表示活化配合物的平均能量。E3-E1=Ea,Ea为正反应的活化能。E3-E2=Ea逆,Ea逆为逆反应的活化能。Ea-Ea逆=△H,△H就是该反应的焓变。
活化配合体是反应物转化为生成物的过程中,分子构型发生连续变化时的一种表现,所以又称为过渡状态。活化配合体分子具有较高的能量,它不稳定,会很快分解为产物分子,也可能分解为反应物分子,使系统的能量降低。由此可见,只有反应物分子具有足够的能量克服形成活化配合体的能垒,才有可能使旧键破裂,新键形成,得到生成物分子。
相关文章