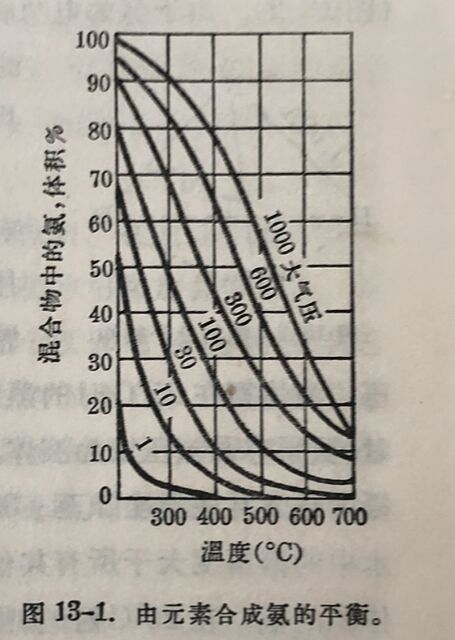
氰氨化鈣CaCN₂是氨的另一来源。它是由氨与碳化鈣在1200°C时作用而制得
CaC₂+N₂=CaCN₂+C
以水汽处理,氰氨化鈣程水解而产生氨
CaCN₂+3H₂O=CaCO₃+2NH₃
現在工业生产的氰氨化钙皆直接用作肥料,极少用于氨的制备。
实驗室制备氨的方法是以强碱(一般为氫氧化鈣)分解銨盐,如氯化铵
2NH₄CI+Ca(OH)₂=CaCl₂+2NH₃+2H₂O
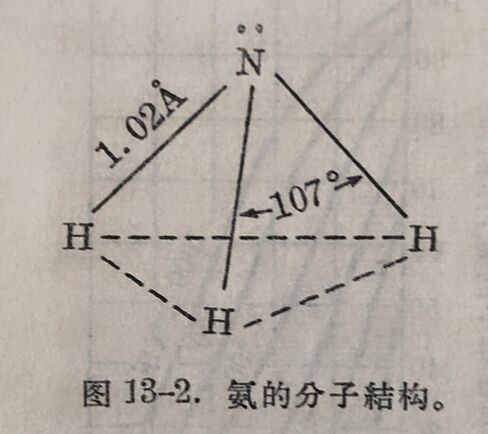
(ii)性质 在氨分子里, H是与N的四个sp³杂化軌道中三个軌道键合(4-5节,图4-8),故分子呈三角雏形,氮原子位于顶上(图13-2)。由于氮的电负性敕氢为高,化合键虽为共价,但共享的电子对是倡向氮原子,因而整个分子具有很大的极性,偶极长为0.31Å。
氨是无色气体,具有特征的刺激臭味。当冷却到-33.4°C时即凝为液体,并在-77.7°C时凝为无色晶体。它的临界温度为133°C,临界压力为112大气压。液体氨在25°C时的蒸气压为9.90大气压,因此,在这个温度时,氨很容易被压成为液体。液体氨上面的压力降为一大气压时, 氨即蒸发并使温度降至-33°C,蒸发热为每克分子5.64千卡。氨在水中的溶解度大于所有其他气体:在0°C时1体积水約吸收1200体积的氨;在20°C时,約吸收700体积。其浪溶液含25%的氨,比重为0.91。氨的水溶液常称为氨水。随着温度升高,氨的溶解度减小,因此,加热渡溶液时,氨即逸出,有时在实驗室中利用此法以制取少量的氨。放出的氨含有水蒸汽,可使其通过苏打石灰(石灰及苛性鈉的混合物)而得干燥的氨。
氨不与空气反应,但在純氧内燃燒,生成氮和水。
4NH₃+3O₂=2N₂+6H₂O Q=301千卡
在有鉑为接触剂时,这种氧化反应就进一步 使氨变为氧化氮:
4NH₂+5O₂=4NO+6H₂O Q=215千卡
这个接触氧化作用是工业上从氨制造硝酸的基础。气体氨通过某些加热的氧化物,如CuO,也能被氧化为氮;气体氨与氯和溴可起强烈作用:
3Cl₂+2NH₃=N₂+6HCI
氨在溶液内的氧化作用将在下节中討論。
氨的加合作用是很突出的。很多盐能吸收氨而生成秸晶形的氨合物,例如AgCl·3NH₃、 CaCl₂·8NH₃,CuSO₄·4NH₃等等。从其生成情况和稳定性看,氨合物是和結晶水合物相似的。这是可以理解的,因为氨与水都是极性很高的分子。在水溶液内,氨也与許多金屬离子形成氨格离子,如Ag(NH₃)₂⁺、Cu(NH₃)₄⁺⁺、Co(NH₃)₆⁺⁺⁺等等。




![2,2-双[4-(4-氨基苯氧基苯)]六氟丙烷](images/202103/thumb_img/3458_thumb_G_1615773264954.jpg)