甲烷氧化菌的微生物学特征
化学先生 / 2019-07-27
1906年,Sohngen首先发现,在厌氧条件下生成的大量甲烷,释放到大气中以后其浓度大大降低。他认为,这可能是由于一些微生物或其它因素可以使甲烷分解造成的,继之他就分离出世界上第一株甲烷氧化菌Bacillus meth-anicus。自此以后不断有新的菌株被分离出来,到目前为止已发现了一百余株甲烷氧化菌。基于细胞形态学分析、细胞体止期类型、细胞内质膜的精细结构和一些生理学特性,Whittenbury将甲烷氧化菌分为五种类型,即甲基弯菌属(Methylosinus)、 甲基孢囊菌属(Methylecystis)、 甲基单胞菌属(Meth-ylomonas)、甲基杆菌属( Methylobacter)和甲基球菌属(Meth ylococcus)。根据细胞代谢途径,这些不同类型的菌株又被划分为3个菌群:I型、II型、X型。近几年来,又报道了5个新的甲烷氧化菌类型,如图2-1所示。也有些报道将X型甲烷氧化菌归人到I型菌中,因为它的表型和代谢途径类似于I型菌,只是它含有低水平的丝氨酸代谢所需要的二磷酸核酮糖磷酸酶。
从内质膜的精细结构看,I型菌主要含有圆盘状堆积的内质膜束贯穿整个细胞,膜内含有16碳脂肪酸,主要是通过单磷酸核酮糖(RuMP) 代谢途径,代谢由甲烷经甲醇转化生成的甲醛,II型菌的内质膜排列在细胞外膜周围形成环状,膜中含有18碳脂肪酸,主要是通过丝氨酸(serine) 代谢途径代谢甲醛。最近又有人报道,甲烷氧化菌也存在一种基于四氢甲酰氧嘌呤的C1代谢途径,因此甲烷氧化菌如何代谢甲醇将有可能进一步讨论。Bowman 研究比较了136个甲烷氧化菌中的124个菌的表型,他应用了大量的分类学研究方法,包括DNA-DNA杂交,脂肪酸组成分析,染色体的理化性质和生物进化关系的分析,5S rRNA和16S rRNA的进化相关性分析。通过这些分析表明,能够利用丝氨酸代谢途径的甲烷氧化菌组成了独特的ar Proteobacteria菌群,利用单磷酸核酮糖代谢途径的甲烷氧化菌形成了r Proteobacteria 菌群,而且存在单磷酸核酮糖代谢途径的菌不利用甲烷为碳源,从而构成了另一类甲烷氧化菌β Proteobacteria菌群。
甲烷氧化菌是一类革兰阴性菌,在利用甲烷为唯一碳源和能源方面是独一无二的。几乎所有的甲烷氧化菌都是依靠甲烷生长,也有个别甲烷氧化菌可以利用甲醇、甲胺、卤代甲烷、含硫的甲基化合物和一些裂解的有机化合物中的甲基基团作为碳源。在甲烷氧化菌氧化甲烷的过程中,甲醛是这个代谢过程的重要中间体,细胞以吸收甲醛的形式作为碳源。几乎所有的甲烷氧化菌都是专性甲烷氧化菌,但也有人报道,还存在个别的兼性甲烷氧化菌或限制性兼性甲烷氧化菌。不同属、种的甲烷氧化菌有着不同的代谢一碳物质的途径和能力,它们的细胞结构和化学组成也不同,因此也有不同的一碳 化合物的代谢调节机制。不同菌株对营养物质的需求能力,决定了该菌株在不同生长环境中的竞争能力。因此要理解甲婉代谢的控制因素和甲烷氧化菌的生态学,就必须了解不同甲烷氧化菌的生理学知识。
甲烷氧化菌在生理上和氨氧化菌有相似之处,它们氧化甲烷和氨氧化菌氧化氨的方式是非常相似的,自养生物氨氧化菌属于β Proteobacteria菌群,也能够氧化甲烷,但效率非常低。如前所述,甲烷的氧化主要发生在有氧的环境中,迄今没有报道甲烷在厌氧环境中被微生物氧化的生物化学过程。
在自然界中,甲烷氧化菌分布于湿地、沼泽、河流的沉积物、稻田、海洋、池塘、被污染的土壤、落叶、森林、溪流、污水管道的沉积物中,也有一些与海洋动物脏器共生的甲烷氧化菌。目前,已被表征过的菌株均是专性甲烷氧化菌,它们均有固氮作用,已发现的甲烷氧化菌可能仅仅是自然界中很小的- .部分。随着甲烷氧化菌检测技术的进展,相信会有更多的、不同的甲烷氧化菌被发现。一般来讲,甲烧氧化菌的检测是利用气相色谱测定其对甲烷的消耗。近几年,利用免疫荧光抗体和核酸探针检测的方法,或直接从环境样品中克隆的分子生物学方法用来检测自然界中的甲烷氧化菌也是非常有效可行的。
随着分子生物学的发展,利用基因序列、微生物分类及微生物进化的关系鉴定甲烷氧化菌,也是近年来建立起来的新方法。例如,MeDonald等利用甲烷氧化菌中羟基化酶a亚基和甲醇脱氢酶组分A的基因序列设计的引物被用于筛选、鉴定环境中甲烷氧化菌的工作中,就像16S rDNA杂交探针用于菌株的筛选工作一样准确、高效,因为当其它组分的变化较大的时候,这两个组分是保守的11。甲烷氧化菌的pMMO与氨单加氧酶(AMO)的基因序列有较高的序列保守性,由此推断甲烷氧化菌与氨氧化菌在生物进化关系上是密切相关的。但该方法有一个明显的缺陷,不是所有的微生物都可以采用此方法来鉴定,因为在相同环境中同类微生物的基因序列可能并不都是保守的。通过脂肪酸鉴定微生物结构也是有效的方法之一,特别是对于甲烷氧化菌的结构鉴定是非常有用的。
甲烷氧化菌不能生存在单纯的大气环境中,因为大气中的甲烧不足以支持其氧化反应和细菌的自身生长。只有在土壤和水的沉积物存在下,刚从厌氧细菌层中释放出来的甲烷,才可以维持甲烷氧化菌的生理活动。目前被分离出来的甲烷氧化菌大多生活在室温和中性环境中,其最适pH为3.5~8.0.近年来,也发现了一些在极端环境中生长的甲烷氧化菌,如热温泉、酸性的沼泽和南极条件下生长的菌株。在些湖泊中, 甲烷氧化菌存在 于厌氧层和有氧层之间,特别是有大量的菌株生长在植物的根陈附近,因为在那里有沉积层的甲烷在支持菌株的生长,并有来自于植物根部的氧,甲烧氧化菌的最佳生长环境是氧浓度为20%左右。在高氧浓度和低甲烷浓度环境中,将有利于I型甲烷氧化菌的生长,反之,则有利于II型甲烷氧化菌的生长。
甲烷氧化菌能催化生产单细胞蛋白和许多精细化学品的反应。它们不但能够使厌氧菌产生的甲烷羟基化,而且可以使其它一些烷烃、烯烃和芳香烃发生选择性氧化。甲烷单加氧酶是甲烷氧化细菌中的主要酶系,在常温、常压下,能够催化甲烷转化为甲醇的反应,然后在一系列脱氢酶作用下生成CO2和H2O:

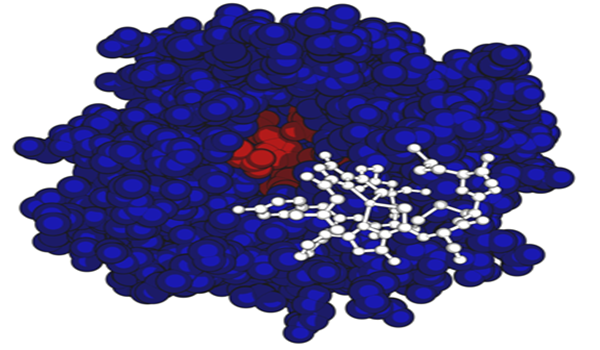
在化学上实现从甲烷到甲醇的直接转化是很困难的,因为甲烷是碳氯化合物中最难发生羟基化的一个底物。它的C- H键十分稳定,键能为438. 8kJ/mol,离子化电位为12.5eV,质子亲和能4.4eV,酸性pK。=48。甲烷单加氧酶在细胞中有两种不同表现形式:溶解性甲烷单加氧酶(soluble MMO,简称sMMO)和颗粒性甲烷单加氧酶( particulate MMO,简称pMMO),它们都可以催化CH生成CH3OH。一般来讲,在目前已发现的甲烷氧化细菌中均含有颗粒性甲烷单加氧酶,它具有较窄的底物专一性,附着在细胞内质膜上。但依靠生长环境中Cu2+的调节,一部分甲烷氧化细菌能够表达溶解性甲烷单加氧酶,特别是在II型甲烷氧化细菌中,当Cu2+浓度较高时,pMMO得到表达;而Cu2+浓度较低时,sMMO得到表达。与pMMO相比,sMMO的作用底物较寬,活性高,表现出具有更宽的底物专一性,且存在于细胞质中,可催化其它低碳烷烃的羟基化和低碳烯烃环氧化和脂肪烃、芳香烃的羟基化反应,以及一些环境污染物(如三氯乙烯等)的降解。正是由于这种宽底物专一性,人们认为sMMO在生物催化过程中会发挥更重要的作用。从而引起了许多科学家的兴趣,并积极努力开发些新的烃类 选择氧化过程和生物除污新方法,在能源、化工和环境保护方面,有着更为广阔的应用前景[17]。迄今为止已对七种甲烷氧化细菌的sMMO进行了分离纯化和表征: Methylocystis sp. WI14、Methylosinus trichosporium OB3b、Methylocystis sp. M、Meth ylococcus cap-sulatus Bath、 Methylobacterium sp. CRL 26、Meth ylosinus trichosporiumIMV 3011 和Methylomonas sp. GYJ3[18~25]。尤其对源于M. trichosporiumOB3b和M.capsulatus Bath 的sMMO进行了较系统的研究。1984年,Datono)从所研究的Bath 菌中得到了一个三组分复合酶体系:羟基化酶(MMO hydroxylase,简称MMOH),分子量为220kDa@,由三个亚基a、B、γ组成(aBY)2 二聚体,含2~4个Fe的金属蛋白:调节蛋白B(MMOB),分子量为14~17kDa,不含辅基和金属蛋白;还原酶(MMO reductase, 简称MMOR),分子量为38~45kDa,含1个Fe2S2(铁硫蛋白)和辅基FAD(flavinadenine dinucleotide,核黄素腺嘌呤核苷酸)的蛋白。其它的sMMO在结构构型上和它们都是非常相似的,都不含有血红素,除了一个甲烷氧化菌Meth-ylobacteriumsp.CRL-26之外,其它菌株的sMMO也都是由三个组分组成的一个复合酶体系,含有双核铁活性中心,在这里分子氧被活化,一个氧插人到甲烷的C- H键中,形成甲醇,另一个氧形成水。与其它具有应用价值的酶相比较,显然有关甲烷单加氧酶的基础性研究信息是缺乏的。羟基化酶是sMMO催化活性的关键组分,也是酶催化反应的活性中心,对它的深入研究,有助于sMMO反应机理和其生物转化、生物除污功能的深入研究。从MMOH的晶体分析看,双核铁活性中心位于距a、β亚基形成的谷底1. 2nm处。组分B是一个小分子调节蛋白,它对整个反应循环的反应速率、MMOH的结构以及产物的分布都有重要的作用,它的活性可能被肽链的N端水解所调节,在低浓度时,组分B调节羟基化酶从一个氧化酶成为一个羟基化酶,稳定氧激活所必需的中间体,饱和量的组分B明显增加了这个中间体,加速了甲烷到甲醇的转化。组分C的功能是接受辅酶NADH电子,将电子传递到羟基化酶,含有[2Fe-2S]中心,能够加速电子从NADH到活性中心的转移。
美国Lipscomb、Lippard、 Newcomb和英国Dalton、Murrell 等教授从酶的生物学特征、分子结构、催化功能、活性中心、反应机理和分子生物学等方面,对甲烷氧化菌和甲烷单加氧酶进行了深入的基础研究。研究较为全面面深人的菌株是Meth ylococcus ca psulatus Bath, Meth ylosinus trichosporiumOB3b.自20世纪80年代中期开始,我国赵树杰、李树本、邢新会等教授,也先后开展了甲烷氧化菌的筛选和甲烷单加氧酶催化化学与功能模拟的研究工作。不但成功地筛选了多株甲烷氧化细菌,并进行了酶和细胞的固定化,以及丙烯环氧化制环氧丙烷,甲烷生物催化氧化制甲醇和三氯乙烯(TCE)降解等生物催化反应研究。从酶化学水平揭示了甲烷单加氧酶对分子氧和小分子烃的活化机理,取得了一系列进展。
和化学催化相比,生物催化过程也存在着某些固有的弱点,如作为生物催化剂的酶在催化循环中自身不够稳定、催化效率低,以及辅酶难以再生等。这些因素都严重影响着生物催化反应循环的连续性,制约了当前酶化学的发展和酶催化在化学工业中的应用。近几年,随着分子生物学技术的日益成熟和迅猛发展,利用基因工程技术构建、改造的工程菌,有可能改善天然酶的性质或使其具有新功能,为解决生物催化中存在的这些国际性的技术难题开辟了新途径。然而,和医学、农业相比,分子生物学在化学化工中的应用研究进展还非常缓慢。