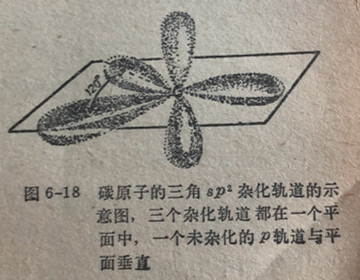
我们发现,在甲烷和乙烷中碳原子的四面体杂化是由于碳的一个2s轨道和二个2轨道发生混合而形成的。在乙烯中出现了不同的情况,由于仅使用了两个2p轨道来和2s轨道混合,于是就象在BF3中一样形成了sp2杂化过程。碳的8p2轨道绘示在图6-18中。和8p2中的情况一样,碳的三个8p2轨道坐落在同一个平面上,并且它们之间按图6-18碳原子的三角82杂化轨道的示
120°角而排布。未杂化的轨道(在图6-18中为垂直于平面的轨道)和62平面相垂直。
当我们把两个82杂化碳原子结合到一起使之形成乙烯分子时,应该要注意的第一点是(参见图6-19)两个82轨道的突出部分,以头对头的方式重叠形成一个强键。第二点应该注意的是两个未杂化的轨道,它们的位置正好使它们能够以肩并肩的方式发生相互作用。这种相互作用产生了一个π键,这类键在第5章里已经讨论过了。轨道重叠形成π键不象轨道重叠形成σ键那么有效,于是x键比σ键弱些。因此乙烯的2个碳原子是通过两类键σ键和x键而结合到一起的。这类结合形式叫做双键。请注意在乙烯分子中4个氢原子和2个碳原子都处在同一个平面之内。
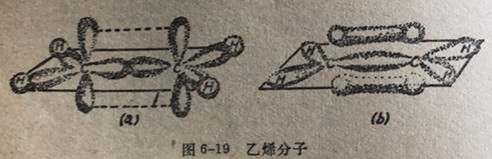
(a)2个893杂化碳原子同来自4个氢原子的4个8轨道的重叠图。其中有4个O-Ho键,一个C=Co键和一个C=0x键(使O-C间的净价键为一双键)。连结两个结包的虚线表示2个未杂化2轨道的肩并肩重叠。8p2杂化轨道处于一个平面中,未杂化的P轨道在平面的上边和下边,并垂直于平面
(b)在乙烯分子中成键轨道的总轮廊。π成键轨道的两部分(由未杂化轨道肩并肩重叠而形成的)处在平面的上边和下边。
编辑网站:https://www.999gou.cn 999化工商城