




















我们对硫酸的性质已经作了初步的介绍.纯硫酸是一种无色粘稠油状液体,几再乎比水重一倍.它能够以任何的比和水混和,同时产生大量的热.硫酸是一种不挥发酸,打开盛贮硫酸的瓶盖,不会冒“烟”,也闻不到什么气味,它的沸点是38C,比盐酸、硝酸等都高得多。

市售的浓硫酸通常浓度是98%,它的比重是1.84下面我们比较详细地来研究一下硫酸的化学性质。
硫酸是一种典型的强酸,它具有酸的一切通性.例如,它能使蓝色石蕊试纸变红;能跟活泼金属发生置换反应,放
出氢气.例如:
H2SO4(稀)+Zn=H2+ZnSO4
金属活动顺序表里氢以后的金属,是不能置换硫酸分子里的氢原子的,虽然其中有些金属(例如铜)在一定条件下,也能溶解在浓硫酸里,但所发生的反应并不是置换反应,这个反应在下面还将详细讨论:
硫酸也能跟碱性氧化物反应生成盐(硫酸盐)和水.例如,
H2SO4 +Cuo=加热=Cuso4(硫酸铜)+H2O
硫酸也能眼碱类发生中和反应.由于硫酸是二价酸,当所用碱的量不同时,它可以生成正盐或酸式盐.例如,
1克分子硫酸跟2克分子氢氧化钠反应时生成正盐:
H2SO4+2NAOH=Na2SO4(硫酸钠) +2H2O
1克分子硫酸跟1克分子氢氧化钠反应时生成酸式盐①:
H2SO4 +NAOH= NAHSO4(酸式硫酸钠或硫酸氢钠) +H2O
最后,硫酸也能跟其他酸的盐类发生复分解反应,生成新酸和新盐.由于硫酸的不挥发性,这个反应广泛地被用来制造其他酸类.例如,
①很显然,如果所用 NAOH超过2克分子,就只能生成正盐;如果少于1克分子就只能生成酸式盐。
H2SO4 +NaC1=加热=NaHSO4+HCI
H2SO4 +NANO3=加热=NAHSO4 +HNO3
硫酸除了具有上述这些酸的通性以外,浓硫酸还有许多特殊的性质,这些性质不仅和其他酸类不同,而且和稀硫酸也不相同,主要是:
1.浓硫具有很强的氧化性,上面讲到某些不活泼的金属(例如铜)不能从稀硫酸里置换出氢氯,但当跟浓硫酸共热时,却能发生化学反应,使金属溶解在浓硫酸里.但这个反应并不放出氢气,它是由浓硫酸的强烈的氧化性而发生的。
浓硫酸眼铜反应时,首先是浓硫酸把铜氧化成氧化铜,而自己则被还原成亚硫酸:
H2SO4(浓)+Cu=Cuo+H2SO3
我们知道,亚硫酸是极不稳定的,生成后立刻分解成二氧化硫和水:
HUS03=S02+H2O
另外,铜被氧化生成的氧化铜是一种碱性氧化物,它能跟多余的硫酸发生复分解反应,生成硫酸铜和水:
Cuo+H2S04=Cuso4 +H2O
这样,铜就溶解在浓硫酸里了①
把上面这些反应的化学方程式合并起来,就可看到浓硫酸跟铜反应总的化学方程式是
2H2S0+Cu=Cuso4+SO+2H2O
把这个反应和活泼金属(例如Zn)跟稀硫酸发生的置换反应相比较,就可看出它们之间存在着本质的不同,前者反应的最后,虽然也生成金属盐类,但它放出的气体不是氢气而是二氧化硫,同时还有水生成。
①稀硫没有氧化性,国此,稀硫酸和铜是没有反应的
浓硫酸跟例的反应是一个氧化一还原反应,在这个反应里,浓硫酸是氧化剂,它把铜氧化成氧化铜(后来又跟多余的硫酸反应生成硫酸铜和水);是还原剂,它把硫酸还原成亚硫酸(随即分解成二氧化硫和水)。
由于浓硫酸具有强烈的氧化性,我们可以用铁器来盛贮它.当铁和浓硫酸接触时,它的表面立刻被浓硫酸氧化成一种组成比较复杂的铁的氧化物,这种铁的氧化物不能溶解在浓硫酸里,它在金属表面上形成一层非常致密的薄膜,保护住内部金属不再受酸的作用.金属跟酸反应后,在表面上形成具有保护性的薄膜的作用,称做金属的“钝化”(注意,铁器不能用来盛贮稀硫酸,为什么?)。
浓硫酸也能跟某些金属发生类似的氧化一还原反应,例如把木炭粉和浓硫酸放在试管里加热时,木炭就被浓硫酸氧化成二氧化碳,同时,硫酸则被木炭还原成亚硫酸(随即分解成二氧化硫和水),总的反应是:
C+2H2SO4=加热=CO2+2S02个+2H2O
2.浓碗酸跟水的反应浓硫酸溶解于水时,会放出大量的热.在第一册§5·4里,我们曾着重指出,在稀释浓硫酸时,一定要把浓硫酸慢慢地沿着容器的壁注入水里,注入时还须,不断加以搅动千万不要把水注入浓硫酸里否则,就可能会有硫酸飞溅出来,沾到皮肤或眼睛上,造成严重的伤害事故。
浓硫酸溶解于水放出大量的热这一事实,说明了浓硫酸的溶解过程,并不是一个简单的物理过程,而是同时包含有硫酸跟水之间发生的化学反应,这种反应可以用下面的化学方程式表示:
H2SO4+H2O=H2SO4.H2O(一水合硫酸)或H4S05
H2SO4+2H2O=H2SO4.2H2O(二水合硫酸)H6SO6
这些反应发生时,都有大量的热放出,这就是浓硫酸溶解时发热的原因.反应后生成的化合物,叫做硫酸水合物,在硫酸溶液里,这些水合物都是实际存在着的。
 浓硫酸跟水的化合能力十分强烈,不跟硫酸起反应的气体,在通过盛浓硫酸的洗气瓶(图210)后,其中含有的水蒸气就被浓硫酸所吸收,因而使气体变得干燥。
浓硫酸跟水的化合能力十分强烈,不跟硫酸起反应的气体,在通过盛浓硫酸的洗气瓶(图210)后,其中含有的水蒸气就被浓硫酸所吸收,因而使气体变得干燥。
浓硫酸也能吸收空气里的水蒸气,因此,浓硫酸常用在干燥器里。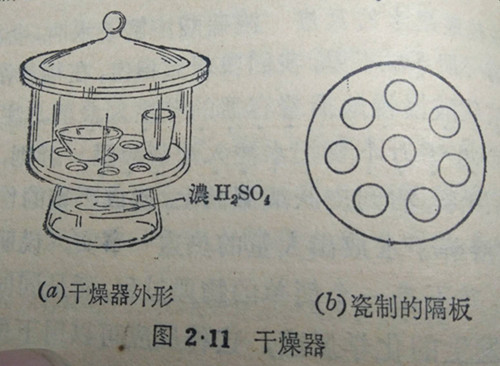
干燥器是一个有盖的玻璃缸.在干燥器的下部装有浓硫酸或其他干燥剂如无水氯化钙等(图2·11(a),硫酸上面搁置一块有许多圆孔的制的隔板(图2-11(b).要干燥的物质先放在坩埚或发皿里,然后再把坩埚或蒸发皿放在隔板上,盖紧缸盖.玻璃缸里的空气,因它所含的水藤气被浓硫酸所吸收而变得十分干燥,这样,就能使坩埚或蒸发皿里的物质一直保持干燥。
3.浓硫酿对有机物的脱水作用有些有机化合物(例如纤维素、糖、淀粉等,在第四册要详细讨论)是由碳、氢、氧三种元素组成的,这类有机化合物遇浓硫酸时,成分里的氢、氧两元素按照水的组成(即按照2个原子氢和1个原子氧的比)被浓硫酸吸收掉.这种作用,叫做有机物的脱水作用.有机物经脱水后就变成为炭(因为这时它成分里只剩下碳一种元素了),我们称这种作用为“碳化”.例如,在蔗糖(它的分子式是C12H22O11)里加入浓硫酸,不久,蔗糖被浓硫酸脱水而变成焦黑色的炭,反应的化学方程式是:
C12H22O11=浓硫酸=12C+11H2O
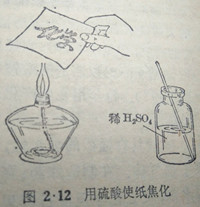 浓硫酸对有机物的脱水作用,还可以从下面的实验清楚地观察到。先用稀硫酸在普通的纸(它大部分是由纤维素组成的)上写好字,然后在酒精灯火焰的上方(要隔开相当距离)慢慢烘干.这时,稀硫酸由于水分蒸发而逐渐浓缩缩,变成浓硫酸,纸上写字的地方因碳化而变成焦黑,原来写的字迹就清楚地显现出来(图212)。
浓硫酸对有机物的脱水作用,还可以从下面的实验清楚地观察到。先用稀硫酸在普通的纸(它大部分是由纤维素组成的)上写好字,然后在酒精灯火焰的上方(要隔开相当距离)慢慢烘干.这时,稀硫酸由于水分蒸发而逐渐浓缩缩,变成浓硫酸,纸上写字的地方因碳化而变成焦黑,原来写的字迹就清楚地显现出来(图212)。
由于浓硫酸对有机物的强烈的脱水作用,如果皮肤上不沾着了浓硫酸,就会引起严重的烫伤,所以,应该尽快地用大量的水或稀的碳酸氢钠( NAHCO3)溶液来冲洗。
浓硫酸溅在衣服上,也会使织物碳化而变成许多小孔,有时在衣服上溅着了稀硫酸,当时并不察觉到,但当干了时,由于水分的蒸发,衣服上的硫酸变浓,也会产生许多小孔,因此在使用硫酸(即使是稀硫酸)时,必须十分小心。