























硅同碳相似,有+Ⅱ及+Ⅳ氧化态的氧化物,不过SiO不及CO稳定,它是白色的晶体,只在高温下存在。
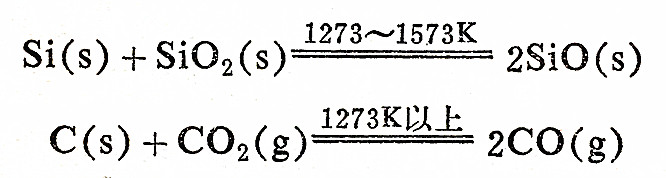
另外,SiO2的结构和性质也与CO2不同。在常温常压下,前者为固体,后者为气体。因为的原子半径比Si的小,在C=O之间可以形成双健,而Si不能。比较键能的大小,也知道Si=O不及C=O稳定。所以Si不能象碳那样以Si=O双键形成有限分子。
| C—C | C—O | C=O | Si—Si | Si—O | Si=O | |
| 键能/(kJ·mol-1) | 345.6 | 357.7 | 798.9 | 222 | 452 | 640.2 |
固态CO2为由CO2小分子组成的分子晶体,而Si通过Si—O键形成三维网格的原子晶体。在此晶体中,每个Si原子以四个共价键与四个氧原子结合,而许多四面体又通过顶点的氧原子连成一个整体,即每个氧原子为两个四面体所共有(见图14-3)。因此,从总体上看,Si:O=1:2,所以二氧化硅的最简式为SiO2。但是此式不象CO2,并不表示单个分子。
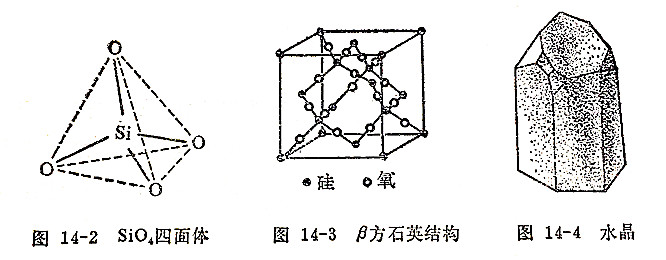
从地面往下16公里儿乎有65%为二氧化硅的矿石。天然的二氧化硅分为晶态和无定形两大类。晶态二氧化硅主要存在于石英矿中,它有石英、鳞石英和方石英三种变体。纯石英为无色晶体,大而透明的棱柱状石英称为水晶(图14-4)。紫水晶、玛瑙和碧玉都是含杂质的有色晶体。砂子也是混有杂质的石英细粒。硅藻土则是无定形二氧化硅。
动植物体内也含有少量的二氧化硅。一般说来,植物中结实的茎和穗,含二氧化硅也较多,如麦杆灰中含SiO2就很多。
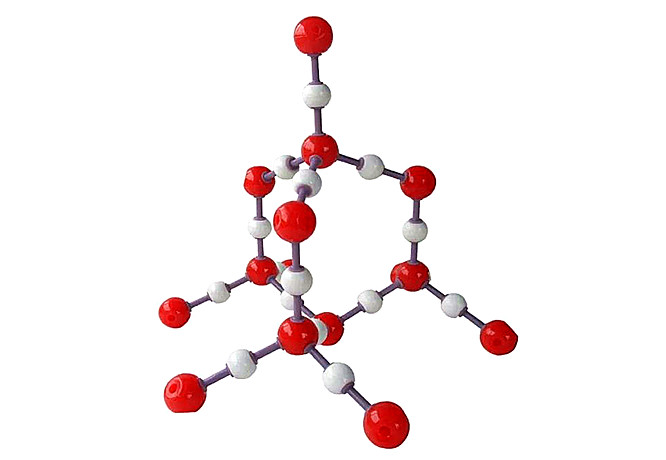
因为SiO2为原子晶体,且Si—O的键能很高,所以石英的硬度大,熔点高。将石英在1873K熔融,冷却时,它不再成为晶体,只是缓慢地硬化,成为石英玻璃,这实际上是一种过冷液体。无论是熔融的SiO2或是石英玻璃,它们仍然由SiO4四面体组成,只不过排列不象在石英晶体中那么整齐。
石英玻璃的热膨胀系数小,可以耐受温度的剧变,灼烧后立即投入冷水中也不致于破裂,可用以制造耐高温的仪器。石英玻璃能透过紫外线,可用以制造医学和矿井中用的水银石英灯和其它光学仪器。石英在高温时仍为电的良好绝缘体。将石英拉成丝,这种丝具有很大的强度和弹性。石英玻璃的一项重要新用途,即是制光导纤维,用在光导通讯上。

硅藻土为多孔性物质,是工业上常用的吸附剂,又是建筑工程上用的绝热隔音材料。
二氧化硅的化学性质不活泼,在高温下也不能被H2还原,只能为镁、铝或硼所还原。
SiO2+2Mg=(高温)2MgO+Si
除F2和HF以外,它不与其它卤素和酸类作用。它与HF水溶液反应的产物也是氟硅酸。
但是SiO2为酸性氧化物,能与热的浓碱或熔融的碱或碳酸钠反应,得到硅酸盐。
SiO2+2NaOH=Na2SiO3+H2O
SiO2+Na2CO3=(熔融)Na2SiO3+CO2↑
玻璃含有SiO2,所以玻璃能被碱腐蚀。