- 碳

- 碳:碳原子在基态时的电子结构是1s22s22p2,按照洪特规则,有两个2p电子没有成对。为了说明碳正常的四价状态,我们必须认为它被激发至2s2px2py2pz构型的化合价态。
- 铊

- 铊:一种稀少而分布广泛的金属元素,外表与锡相似,但在空气中其表层容易形成为氧化物,展性如铅,但较软,产状以化合物形态见于少数矿物(例如硒铊银铜矿和红铊矿)内,毒性极大,主要以化合物的形式应用 ——元素符号Tl
- 铝和镓

- 铝和镓:没有证明在常温下存在着含有Alᴵ的化合物。在高电流密度下,铝的阳极氧化,明显地产生低价铝离子Alᴵ或AIᴵᴵ,或两者同时都有,但它们是暂时的。在高温下存在着气态AIᴵ卤化物分子却是毫无疑问的,并且它们的分光性质是熟知的。
- 氧络合物

- 氧络合物:人们已经注意到水合及铝酸根离子。醋酸铝的结构与Cr³⁺,Fe³⁺及其它M³⁺离子的碱式醋酸盐的相似,且可能含有碱式单元[Al₃O(OOCMe)₆(H₂O)₃]⁺,其中的水分子能解离成OH,或能被其它配位体所置换。
- 元素的分布
- 元素的分布:地球除地壳部分可以直接研究外,它的内部秸构是依靠地震波在不同密度各层间的反射作用而得出结论的。地球按课度分层,共有五个层,称为界,
- 氧化物性质

- 氧化物:除惰性气体外,所有其他元素都生成氧化物,并且在氧化物中最容易表现出元素的最高正价。象上节中談到卤化物时,就看到錸不能生成七价的氟化物,釕不能生成八价的氟化物,但是錸有Re₂O₇和KReO₄,非常稳定,釕也有RuO₄。此外象Mn、Tc沒有七价的氟化物,而有Mn₂O₇、KMnO₄和Tc₂O₇、KTcO₄又如Cr沒有六价的氟化物,但是有CrO₃和K₂CrO₄。原因很简单,一个氧原子所占的空間要比二个氟原子来得小。
- 卤化物性质
- 卤化物:絕大多数元素生成卤化物。如果元素的原子价是n,那末生成的卤化物具有MXn型的分子式。n可能就是M在周期系中的族次,即最高正价,在第I至IV族中就是这样。其中銅副族是例外,因为它邻近铁鉑系,变价的趋势大,原来一价的金属只能变为有較高价,因此有CuCl₂、AgF₂、AuCl₃等卤化物。
- 氫化物
- 氫化物:元素的氫化物共分四类。最普通的是具有揮发性的分子型氫化物,如HCl、H₂O、NH₃、CH₄等,其次是盐型氫化物,如NaH、CaH₂等,氢在这些化合物中以负一价离子形式而存在。第 三种是金屬型氫化物,例如CuH、NiH₂、CoH₂、FeH₂、ZnH₂、CdH₂、BeH₂、MgH₂,它們的晶格和原来的金屬不同,而在晶格中有自由电子存在。
- 元素的第一电离势
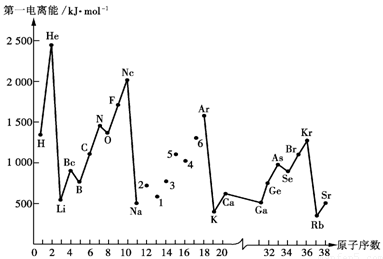
- 元素的第一电离势:要把各元素的原子脫去第一个电子所需要的能量,叫做第一电离势。图28-3示元素按原子序递增大序的第一电离势。显然所有惰性气体无来都占峰瓜,因为它們的原子都局满层的稳定结构。另一方面碱金属元素都处在谷底,因为新增壳局的s电子具有比较大的轨道半径,离核較远,同时核电荷对前面一个惰性气体来说仅增加了一个单位。
- 元素熔点和沸点变化的周期性
- 元素熔点和沸点变化的周期性:元素的熔点和沸点,随着原子序的递增,也呈現着周期性的变化。熔点曲线,在每个周期中,惰性气体处在谷底,而处在峰頂的是C、Si、Cr、Mo、W,前二个元素服IVA族(第四主族),后三个元素属VIB族(第六副族,即鉻副族)。





