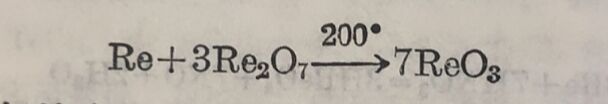錸的化合物
铜臭 / 2022-08-09
1.氧化物、含氧酸及其盐
已知錸的氧化物有Re₂O₃、ReO₂、ReO₃和Re₂O₇。
錸在350°与氧直接作用而生成七氧化二錸Re₂O₇,它为黄色 固体,熔点300.3°,沸点360.3°。Re₂O₇与Tc₂O₇相同,比Mn₂O₇稳定得多。易溶于水而形成高錸酸HReO₄,酸性比HMnO₄弱,氧化性比HTeO₄低。
高錸酸鉀KReO₄在555°熔化,在1370°气化而不分解,故热稳定性比KMnO₄高得多,因后者在200°以上就分解。高錸酸鉀是一个弱氧化剂,它与很强的还原剂作用时就生成低价錸的化合物。錸还形成一种新高錸酸盐M₃⁽ᴵ⁾ReO₅,类似的高錳酸盐和高锝酸盐皆不存在。在碲酸和硒酸,高碘酸和高氯酸之間也有类似的区别(如H₂SeO₄和H₆TeO₆; HCIO₄和H₅IO₆),在同一族内,如离子半徑大,配位数即可增多。
热分解NH₄ReO₄或加热于Re₂O₇+Re,則得錸的較低的氧化物,例如
将Re₂O₇在氫气流中加热到300°即得二氧化錸ReO₂。在隔艳空气的情况下,ReO₂与NaOH混合熔融,即生成亚錸酸鈉:
ReO₂+2NaOH=Na₂ReO₃+H₂O
水合三氧化二錸Re₂O₃·xH₂O可用加碱于Re₂Cl₆溶液的方法而制得,但极不稳定,很容易被水氧化为ReO₂·xH₂O。
Re₂O₃·xH₂O+(x+1)H₂O=2ReO₂·xH₂O+H₂
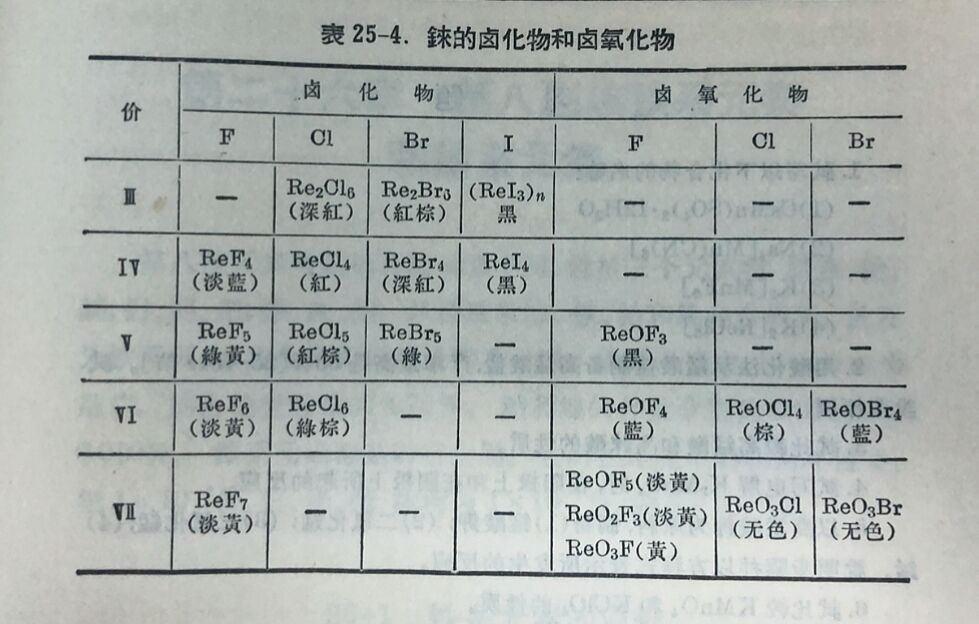
2.卤化物
已知的卤化物列于表25-4。錸有四种氟化物, 共中最普通的是六氟化錸ReF₆。它是由錸与氟在120°直接作用而产生,熔点18.8°,极易水解而形 成ReO₂, HReO₄和HF。七氟化錸ReF₇也是由金属与氟在400°加压下直接化合而产生。用羰基金屬还原ReFe₆,除得ReF₄和氟氧化錸而外,也有ReF₅产生。固体ReF₄的最好制法是用氢在200°还原ReF₆。
在氯气里加热于由热分解NH₄ReO₄而得的金屬錸时就生成六氯化錸ReCl₆。若用普通金屬錸粉末与氯在500°加热,則得五氯化錸ReCl₅。五氯化物在氮气氛中加热,就失去部分氯而产生Re₂Cl₆。这些氯化物皆易水解。
其他卤化物都不很重要。四溴化物和四碘化物皆可在过量HBr或HI的溶液中蒸发HReO₄而制得。四碘化物不稳定,在封阴管中加热印分解为ReI₃。
3.硫化物
相应于ReO₂和Re₂O₇,有两个硫化物ReS₂和Re₂S₇。它們和相邻元素鎢和鋨的硫化物的关系,可由表25-5看出。虽然它們都形成MS₂,但所在族最高价的硫化物自然不相同。将高錸酸的溶液通以H₂S,就有暗綠色的七硫化二錸Re₂S₇析出。
表25-5 錸、鎢和鋨的硫化物
| VI族 |
VII族 |
VIII族 |
|
WS₂
WS₃
|
ReS₂
Re₂S₇
|
OsS₂
OsS₄
|
2HReO₄+7H₂S=Re₂S₇+8H₂O
在情气流中将Re₂S₇加热到600°,即分解为黑色的二硫化錸ReS₂和S:
Re₂S₇=2ReS₂+3S