















































一、絡合物的命名法
我們常見的络合物,例如K₃Fe(CN)₆通常称为铁氰化鉀,K₄Fe(CN)₆通 常称为亚铁氯化鉀,Ag(NH₃)₂⁺称为限氨格离子,Ag(CN)₃⁻⁻称为銀氰络离子,这些都是习惯上常用的名詞,并不完全符合于格合物的命名原则。络合物的命名,应說明貉离子或络合分子的粗成。例如Co(NH₃)₆³⁺应該称为六氨合鈷⁽ᴵᴵᴵ⁾耳络离子(絡字可以省去),括弧中的⁽ᴵᴵᴵ⁾,表明中心离子是三价鈷。在一般情况下,这是有它的必要性的。络离子[Co(NH₃)₅(H₂O)]³⁺在命名时应先水后氨,称为一水五氨合鈷⁽ᴵᴵᴵ⁾絡离子。Co(NH₃)₆Cl₃和[Co(NH₃)₅(H₂O)](NO₃)₃依次为氯化六氨合鈷⁽ᴵᴵᴵ⁾[或六氨合鈷⁽ᴵᴵᴵ⁾氯化物]和硝酸一水五氨合鈷⁽ᴵᴵᴵ⁾[或一水五氦合鈷⁽ᴵᴵᴵ⁾硝酸盐]。如酸根(即阴离子)和中性分子同存于络合物的内界,則命名时应以阴离子放在前面。例如[Co (NH₃)₄Cl₂]⁺和[Co(NH₃)₂(NO₂)₄]⁻,依次为二氯四氨合鈷⁽ᴵᴵᴵ⁾絡离子和四硝基二氨合鈷⁽ᴵᴵᴵ⁾络离子。相应的盐[Co(NH₃)₄Cl₂]NO₃和K[Co(NH₃)₂(NO₂)₄]依次为硝酸二氯四氨合鈷⁽ᴵᴵᴵ⁾络离子和四硝基二氨合鈷⁽ᴵᴵᴵ⁾酸钾。中性的[Co(NH₃)₃Cl₃]应称为三氯三氨合鈷⁽ᴵᴵᴵ⁾。在有些例子中, 似乎可以不必表明中心离子的价数。例如K₂PtCl₆称为六氯合鉑酸鉀(通常称为氯鉑酸鉀) K₂PtCl₄称为四氯合亚鉑酸鉀(通常称为氯亚鉑酸鉀)。但中心离子具有不同的价数时用括弧表明它的价数,是比較明确妥善。前者应該称为六氯合鉑⁽ᴵᵛ⁾酸鉀,后者称为四氯合鉑⁽ᴵᴵ⁾酸鉀。
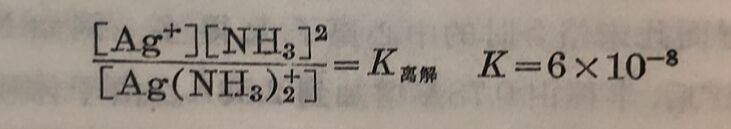
Co(NH₃)₆⁺⁺ 1.25x10⁻⁵ Ag(CN)₃⁻⁻ 8x10-23
Co(NH₃)₆³⁺ 2.2X10⁻³⁴ Fe(CN)₆⁴⁻ 10⁻³⁴(約數)
Ni(NH₃)₄⁺⁺ 4.8x10⁻⁸ Fe(CN)₆³⁻ 10⁻⁴⁴(約數)
这些不稳定常数,都是用实驗方法求得的。应用这些常数,可以解决許多化学上遇到的問題。