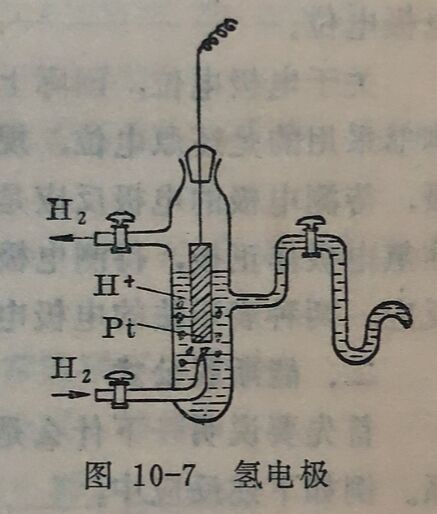
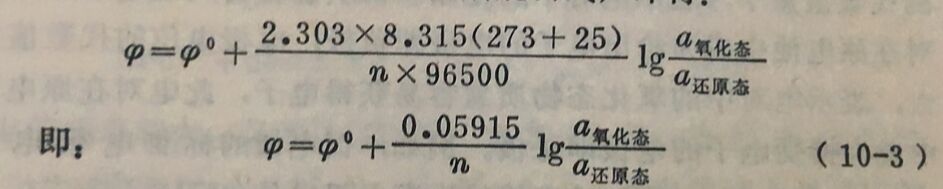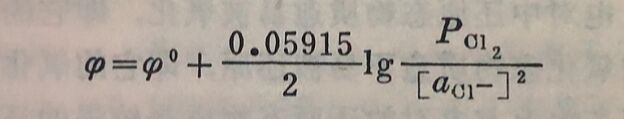如要测定某一待测电极的电极电位时,可将此电极与标准氢电极组成一原电池,并规定标准氢电极作负极,待测电极作正极。然后测量这一电池的电动势,因标准氢电极电位为零,故测得的值就是待测电极的电极电位,用符号φ表示。由于规定待测电极作正极,电极反应是还原反应,故测得的电极电位称还原电位。
由于电极电位的值是随条件而变化的,所以在比较各种电极的电极电位时,必须在相同条件下进行,即温度和溶液中各离子的活度相同,若是气体电极时,各气体的压力相同。通常采用25°C,离子活度等于1克离子/升,气体的分压等于1大气压。在这种条件下,与标准氢电极比较所得的电极电位,叫做待测电极的标准电极电位,用符号φ⁰表示。各种电极的标准电极电位请参阅附录表7。
例如在25°C时,由Cu和Cu²⁺组成的电极和标准氢电极组成电池,按规定标准氢电极为负极,铜电极为正极:
Pt,H₂(PH₂= 1大气压) |H⁺(aH₊=1)|Cu²⁺(acu²⁺=1)|Cu测得此电池的电动势为0.34伏。因此铜电极的标准电极电位 φ⁰cu²⁺/cu=+0.34伏。同法测定Zn与Zn²⁺组成电极的标准电极电位时,按规定标准氢电极为负极时,测得的电动势为-0.76 伏,即φ⁰za²⁺/Zn=-0.76伏。电动势是负值,即待测电极的电极电位是负值。实际上,电动势是负值的原电池是不能存在的:只有将锌电极作负极,氢电极作正极时,才能组成原电池,此原电 池的电动势为+0.76伏。同样,各种电极都可以用此法测得其标准电极电位。
关于电极电位,国际上有还原电位和氧化电位两种表示法。本书采用的是还原电位,规定标准氢电极为负极,待测电极为正极,待测电极的电极反应是还原反应。氧化电位表示法则规定标准氢电极作正极,待测电极作负极,待测电极的电极反应是氧化反应。两种表示法的电极电位值相同,但符号相反。
二、能斯脱公式
首先要说明一下什么是氧化态和还原态,以及它们之间的关系。例如下述反应中:
Zn²⁺+2e⇔Zn
Zn²⁺得到电子,被还原成Zn。Zn是Zn²⁺的还原产物,称为还原态。Zn失去电子,被氧化成为Zn²⁺,Zn²⁺是Zn的氧化产物,称为氧化态。Zn与Zn²⁺组成一个氧化还原电对。任一个电极都是一个氧化还原电对,都有氧化态和还原态,化合价低的物质为还原态,高的为氧化态,因此可写成下列通式:
氧化态+ne⇔还原态
式中n是氧化态和还原态互相转化时得失的电子数。电极作为正极时,上述反应向右进行。
如前所述,电极电位是随离子活度和温度而变化的。能斯脱公式表达了它们之间的数学关系式。这里着重说明能斯脱公式的应用,不作理论推导。
电极作为正极,其电极电位用能斯脱公式表达时为:
为了便于计算,能斯脱公式中的常数项可以合并。
在25°C时,将各常数代入能斯脱公式,即得:
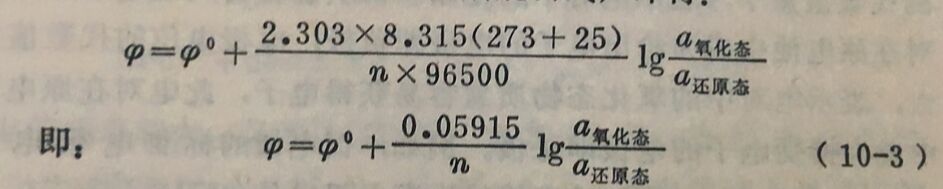
如果电极反应式中,氧化态或还原态物质前面有系数时,则在能斯脱公式中应以此系数作为对应物质活度(或近似地为浓度)的方次数。例如氯电极反应:
Cl₂+2e⇔2Cl⁻
在25°C时,其电极电位的表示式为:
用能斯脱公式可以计算给定电极在某浓度和某温度下的电极电位。必须注意,这样计算所得的电极电位φ,为还原电位。
三、电极电位的应用
1.确定电池的正负极。任一原电池都是由两个电极(又称半 电池)组成的。这里电极决不是指某一种金属, 而是指由某种元素的氧化态和还原态物质组成的一个氧化还原电对。根据电极电位的大小很容易判断电池中,哪个是正极,哪个是负极。因为电极的电极电位都是与标准氢电极比较得来的数据,所以电极电位的代数值愈小,表示电对中的还原态物质愈容易失去电子,此电对在原电池中成为给出电子的电极即负极;电极电位的代数值愈大,表示电对中的氧化态物质愈容易获得电子,此电对在原电池中成为接受电子的电极即正极。例如,铜电极的标准电极电位φ⁰cu²⁺/Cu=+0.34伏,铁电极的标准电极电位φ⁰Fe²⁺/Fe=-0.44伏。由它们组成的电池中,铜电极应是正极。
2.比较物质氧化性和还原性的强弱。比较物质氧化性和还原 性的强弱,一般可根据电极电位表进行。标准电极电位表是按电极电位代数值由小到大顺序排列的。电极电位的代数值愈小,电对中还原态物质愈易被氧化,即它的还原能力愈强,而对应的氧化态物质愈不易被还原,即它的氧化能力愈弱。因此,附录表7中上方电对的还原态物质是较强的还原剂,下方电对的氧化态物质是较强的氧化剂。从上往下,电对中还原剂的还原性依次减弱,氧化剂的氧化性依次增强。例如Li⁺/Li电对的电极电位值最小,列于表的最上端,故Li是最强的还原剂;而对应的Li⁺几乎不具有氧化性。F₂/F⁻电对的电极电位值最大,列于表的最下端,故F₂是最强的氧化剂,而对应的F⁻几乎不具有还原性。
3.判断氧化还原反应的方向。知道了氧化剂和还原剂的相对强弱,就能判断氧化还原反应的方向。把氧化还原反应中的反应物与生成物写成两个电对,从附录表7查得两电对的电位并进行比较。当电位较大电对中的氧化态物质作氧化剂、电位较小电对中的还原态物质作还原剂时,反应才能自动进行。一般说来,两个电对的电位相差较大时,可以直接根据标准电极电位判断反应的方向。如果相差较小,或有H⁺和OH⁻参加反应时,离子活度和溶液酸度对电位的影响,足以决定氧化还原反应进行的方向,故必须根据能斯脱公式计算在给定条件下电对的电位,然后才能判断氧化还原反应进行的方向。



















![硝酸铜标准溶液 c[Cu(NO3)2]= 0.01000 mol/L价格](images/202207/thumb_img/1653_thumb_G_1658537651764.jpg)