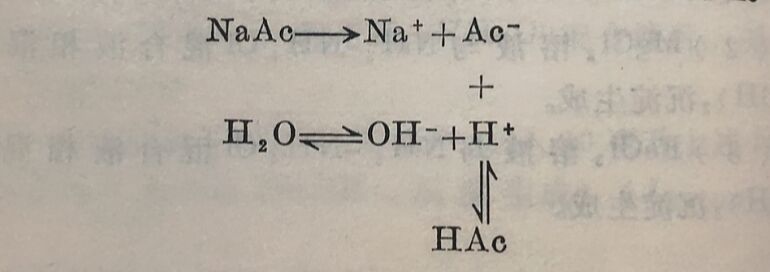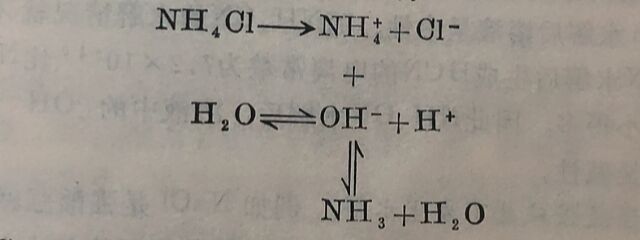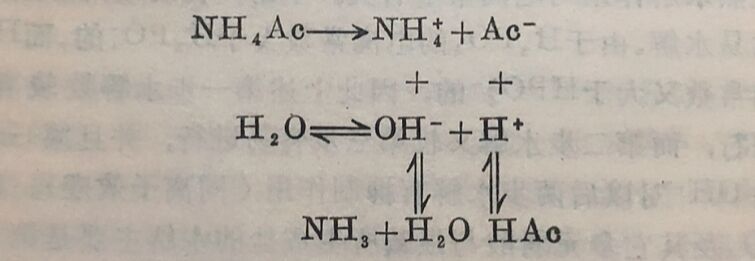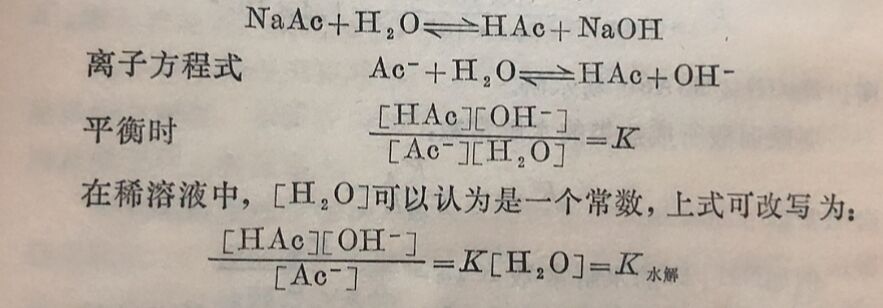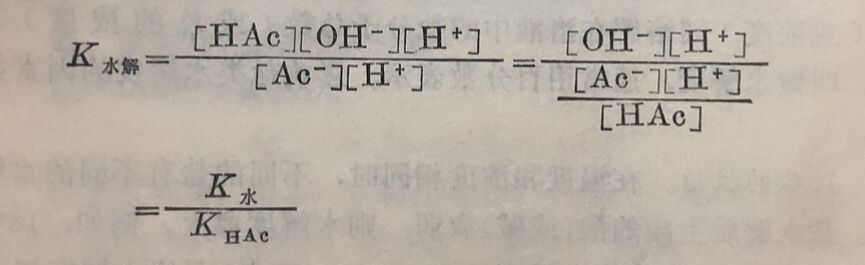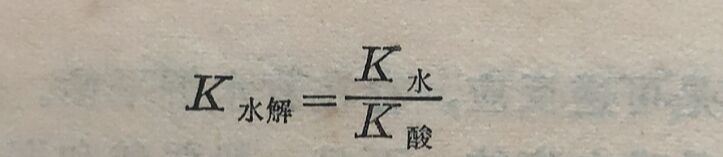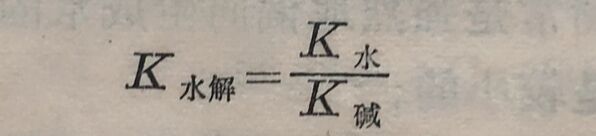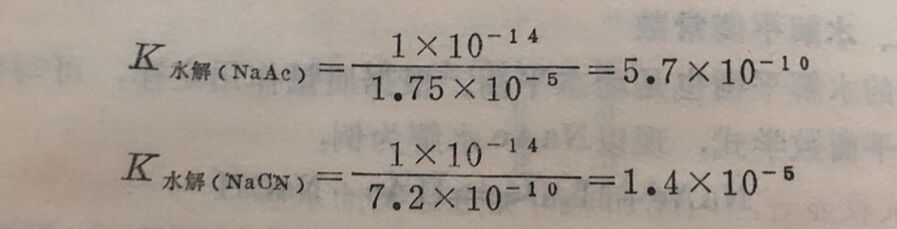显然这时溶液中[OH⁻]较[H⁺]为大,所以溶液呈碱性。NaAc水解的离子方程式为:
Ac⁻+H₂O⇔HAc+OH⁻
由此可以看出,弱酸强碱盐的水解作用的实质是盐中的酸根离子中的一部分与水作用,生成弱酸,使溶液中[OH⁻]>[H⁺],因此溶液呈碱性。
多元弱酸和强碱所生成的盐的水解情况比较复杂,和酸的分步电离类似,水解过程也是分步进行的。例如,Na₃PO₄的水解就是这样进行的:
第一步水解: Na₃PO₄+H₂O⇔Na₂HPO₄+NaOH
或 PO₄³⁻+H₂O⇔HPO₄²⁻+OH⁻
第二步水解: Na₂HPO₄+H₂O⇔NaH₂PO₄+NaOH
或HPO₄²⁻+H₂O⇔H₂PO₄⁻+OH⁻
第三步水解: NaH₂PO₄+ H₂O⇔H₃PO₄+NaOH
或H₂PO₄⁻+H₂O⇔H₃PO₄+OH⁻
显然水解作用与电离常数有关。水解产物的电离常数愈小, 此盐愈易水解。由于H₃PO₄的电离常数大于H₂PO₄⁻的,而H₂PO₄⁻的电离常数又大于HPO₄²⁻的,因此上述第一步水解数较第二步容易进行,而第二步水解又较第三步容易进行,并且第一步水解 产生的OH⁻对以后两步水解有抑制作用(同离子效应)。因此, Na₃PO₄及其它多元弱酸与强碱所生成盐的水解主要是第一步,计算时往往不考虑其它几步的水解。
2.强酸弱碱盐的水解。这种盐的水解情况与弱酸强碱盐的水解相似,所不同的是盐中的正离子中的一部分与水作用,生成弱碱,并使溶液呈酸性。如NH₄CI的水解:
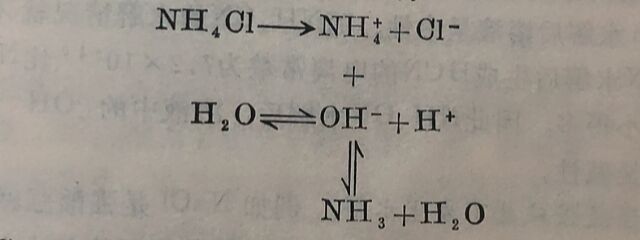
NH₄Cl水解的离子方程式为:
NH₄⁺+H,O⇔NH₃+H₃O⁺(即氢的水合离子,一般仍以H⁺表示)
水解的结果,生成了难电离的弱碱NH₃,溶液中的氢离子相应增加,OH⁻相应减小,使溶液中[H⁺]>[OH⁻],因此溶液显酸性。
强酸与多元弱碱生成的盐,其水解也是分步进行的,而且第一步水解也大于第二步水解,水解产物主要是碱式盐。例如CuCl₂的水解:
第一步水解: Cu²⁺+H₂O⇔Cu(OH)⁺+H⁺
第二步水解: Cu(OH⁻)⁺+H₂O⇔Cu(OH)₂+H⁺
3,弱酸弱碱盐的水解。这类盐水解时,盐的正、负离子都能分别和水电离出来的0H和H结合成弱碱和弱酸,破坏了水的电离平衡,促使平衡向水解方向移动。水解后溶液的酸、碱性,取决于所生成的弱酸和弱碱的相对强度。例如NH₄Ac在溶液中水解时,呈下列平衡:
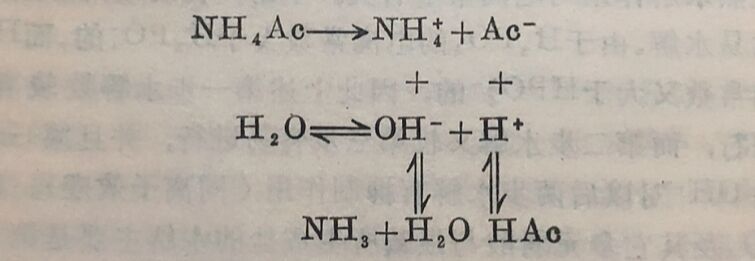
NH₄Ac水解的离子方程式为:
NH₄⁺+Ac⁻+H₂O⇔HAc+NH₃+H₂O
此溶液的酸碱性则决定于HAc和NH₃的相对强度。在25°C时,它们的电离常数均为1.76x10⁻⁵,这说明它们的强度相等,因此NH₄Ac水解后溶液呈中性。而NH₄CN的水解情况就不同了, NH₄CN水解后生成HCN的电离常数为7.2x10⁻¹⁰比NH₃的电离常数小得多,因此NH₄CN水解后,溶液中的[OH⁻]>[H⁺],故溶液呈碱性。
4.强酸强碱盐不发生水解。例如NaCl是强酸强碱所生成的盐,在水中是完全电离的,其正、负离子都不能与水电离出来的OH⁻和H⁺结合,所以这类盐在水溶液中不发生水解反应,它们的溶液呈中性。
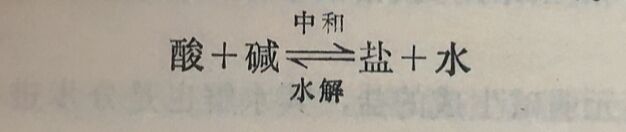
从盐类水解反应方程式可知,盐的水解反应实际上是中和反应的逆反应。其中的酸和碱,至少有一种是弱的。
因此盐的水解是可逆反应,存在着水解平衡。由于水分子、弱酸和弱碱分子都是难电离的,而且一般弱酸和弱碱的电离度都大于水,所以水解平衡常是强烈地偏向生成水的一方。因此,盐类的 水解程度一般 都是较小的。
盐类的水解,在工业生产和日常生活中都有广泛的用途。例如磷酸三钠的水溶液呈碱性,可用来维持电厂炉水的pH,并且在一定条件下,能把炉水中Ca²⁺和Mg²⁺结合成水流,从而防止水垢的产生,因此磷酸盐可用作锅内水处理药剂;氯化铁和明矾水解生成的氢氧化铁和氢氧化铝,都能把水里的悬浮杂质吸附在它们的表面而除掉,因此它们都可用作水的混凝剂。
二、水解平衡常数
盐的水解平衡也是动态平衡。根据质量作用定律,可写出盐的水解平衡数学式,现以NaAc水解为例:
因上面的反应是水解反应,所以这个平衡常数K水解称为盐的水解常数。K水解同其它化学平衡常数一样,在温度一定时为定值。水解常数在一般书中不能查到,需要通过其它常数求得。如将上式分子、分母各乘以[H⁺],即得:
对于任何弱酸强碱所成盐的水解常数,可用下式计算:
同样可导出弱碱强酸所成盐的水解常数:
式中 K碱——盐水解所生 成弱碱的电离常数。
由于在一定温度下,K水是一个定值,因此水解常数K水解的值,只决定于水解产物的电离常数K酸和K碱。故反应生成的酸、碱愈弱,K酸、K碱愈小,K水解就愈大,盐的水解程度愈大,盐 溶液的碱、酸性也愈强。如NaAc 和NaON KHAc=1.75x10⁻⁵,KHCN=7.2×10⁻¹⁰
所以NaCN较NaAc更易水解。
弱碱弱酸所成盐类的水解常数:
由于弱碱弱酸盐类,分母是两个小数K酸、K碱相乘,故其K水解较大。因此这一类盐的水解程度较前面两种盐类要剧烈.