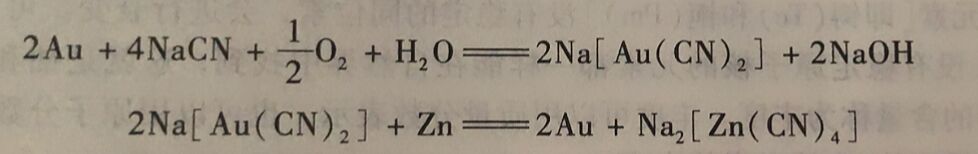单质的存在和制取
铜臭 / 2022-07-14
5.1.1单质的存在
地壳是指围绕地球的大气圈、水圈及地面以下16km深度以内的岩石圈。到2007年为止,总共有117种元素已被大家所承认,其中94种是存在于地壳,其余23种是人工合成的。拥有 原子序数大于82 [即铋(Bi) 及之后的元素]的元素都是不稳定的,并会进行放射衰变。第 43和第61种元素[即锝(Tc)和钷( Pm)]没有稳定的同位素,会进行衰变。可是,即使是原子序数高达94,没有稳定原子核的元素都一样能在自然界中找到,这就是铀和钍的自然衰变。 元素在地壳中的含量称为丰度。丰度可以用质量分数表示,也可以用原子分数表示。表5-1 列出了其中含量最多的10种元素的丰度。
| |
O
|
Si |
AI |
Fe |
Ca |
Na |
K |
Mg |
H |
Ti |
| 质量分数/% |
48.6 |
26.3 |
7.73 |
4.75 |
3.45 |
2.74 |
2.47 |
2.00 |
0.76 |
0.42 |
| 原子分数/% |
53.8 |
18.2 |
5.55 |
1.64 |
1.67 |
2.26 |
0.80 |
1.60 |
13.6 |
0.16 |
由表5-1可见,这10种元素已占地壳总质量(或总原子数)的99%,其余元素含量的总和不超过1%,所以绝大多数元素的丰度是很小的。
习惯上,把在地壳中含量少、比较分散、从天然化合物中提炼困难、发现较晚,对它们研究较少的些 元素都称作稀有元素。其余的元素,则称作普通 元素。如钛在地壳中含量并不少(约0.42%),但由于冶炼困难,在相当长时间里影响了人们对它的了解和应用,因而被列入稀有元素。有些元素,如砷在地壳中的含量很少(约5x10⁻⁶%),但由于有引人注目的硫化物矿存在,这些矿物以及砷元素本身早就为人类所熟知,因此砷未列人稀有元素,而归入普通元素。显然,关于稀有元素和普通元素的划分是相对的。目前在所有的已知元素中,约2/3的元素属于稀有元素。
目前发现的117种元素,按其性质可分为金属元素和非金属元素,金属元素有94种,非金属元素有23种。金属单质具有特殊的金属光泽、导电性和导热性,以及良好的机械加工性;而非金属单质一般不具备这些性质。不过,在p区对角线附近的一些元素,如硼、硅、锗、砷、锑、碲等,它们的性质介于金属和非金属之间,这些元素的单质有“半(准)金属”之称。它们大多具有半导体的性质。
我国矿产资源极为丰富。钨、锌、锑、锂、硼元素等的储量均居世界首位,其中钨占世界储量的75%,锑占44%。其他如锡、铅、汞、铁、锰、铜、镍、钛、硫、磷等储量也居世界前列。具有广阔应用前景的稀土金属元素,在我国并不稀有,其总储量占世界的80%,世界最大的稀土矿区是我国内蒙古的白云鄂博。大力开发和利用我国稀土金属及其他丰产元素,对促进我国的经济建设有十分重要的意义。
5.1.2单质的制取
在地壳中除少量元素,如稀有气体、氧、氮、硫、碳、金、铂系等元素以单质存在外,其他元素均以化合态存在。化合态的物质中最主要的有卤化物、硫化物、氧化物和含氧酸盐等。单质的制取方法大致有五种:
(1)物理分离法 适用于分离、提取那些以单质状态存在,与其杂质在某些物理性质(如密度、沸点等)上有显著差异的元素。以游离态存在的非金属常常可用物理方法分离出来。例如要从空气中分离出氧、氢和稀有气体,可先把空气液化,然后利用它们的沸点不同,用分馏法分离。以游离态存在的金属常常和岩石混在一起,提取时,可先把岩石粉碎,选择适当的选矿法除去不需要的脉石,再用溶剂使金属溶解,最后把金属从溶液中分离出来。例如含金的矿石经粉碎和选矿后,放人稀的氰化钠溶液中,并通人空气,单质金因生成配合物而溶解,然后往滤液中加人锌粉,即可得到单质金
(2)热分解法某些对热不稳定 的金属化合物,可以用热分解法来制取该金属单质。在金属活动性顺序中,位于氢后面的金属的氧化物受热就能分解,例如

(3)电解法电解是实现氧化还原最强有力的手段。 活泼金属如钠、钾、镁、钙、铝等常用电解熔盐或氧化物的方法来制取。电解时,在阴极上金属离子得到电子而被还原为金属单 质。电解溶解在助熔剂冰晶石(Na₃AIF₆) 中的Al₂O₃,在阴极上得到单质铝。
2Al₂O₃=4AI + 3O₂
(4)还原法普通金属在化合物中一般呈正 价,还原的方法有碳还原法、一氧化碳还原法、氨还原法金属还原法和电解法等。例如,用赤铁矿炼铁的反应就是采用一氧化碳还原法。
Fe₂O₃+ 3CO=2Fe + 3CO₂
以硫化物形式存在的金属元素,一般先熔烧成氧化物,然后再还原成金属。例如,从闪锌矿ZnS制取锌的反应如下
2ZnS +3O₂=2ZnO+ 2SO₂
ZnO+C=Zn+CO
金属还原法,就是用活泼金属把不活泼金属从它的化合物中置换出来的方法。例如金属钛 可以首先从钛矿石制得氯化钛TiCl₄然后用镁在800 - 900°C的高温下使其还原而制得。
TiCI₄+2Mg=Ti + 2MgCl₂
钾和铷虽然也可以用电解法制取,但常用强还原性的金属如Na、Ca、Mg. Ba等在高温和低压下还原它们氯化物的方法制取,例如
KCI+Na=NaCl+K↑
2RbCl + Ca=CaCl₂+ 2Rb↑
铯可以用镁还原CsAIO₂制得
2CsAIO₂ + Mg=MgAl₂O₄+ 2Cs
上而几个反应看起来都是较不活泼的金属把活泼金属从其盐类中置换出来,这似乎与金属的标准电极电势排列的金属活动顺序相矛盾。我们已经知道用标准电极电势作反应方向的判断标准,只能在水溶液的情况下应用,而上述反应都是在高温下进行的,所以不能应用。
另外,钾的沸点低易挥发,钾易熔于熔融KCI中难分离,在电解过程中产生的KO₂与K会发生爆炸,所以一-般不用熔融盐电解法制取钾,主要用金属置换法等制取。
(5)氧化法对于以化合态存在的元素,如果它在化合物中呈负价,则用氧化法来制取;否则,则用还原法来制取。例如岩盐中的氯量负价,可用氧化剂或电解的方法来氧化氯
2CI⁻=Cl₂+2e⁻(电解)