气敏电极
同修 / 2022-07-09
气敏电极
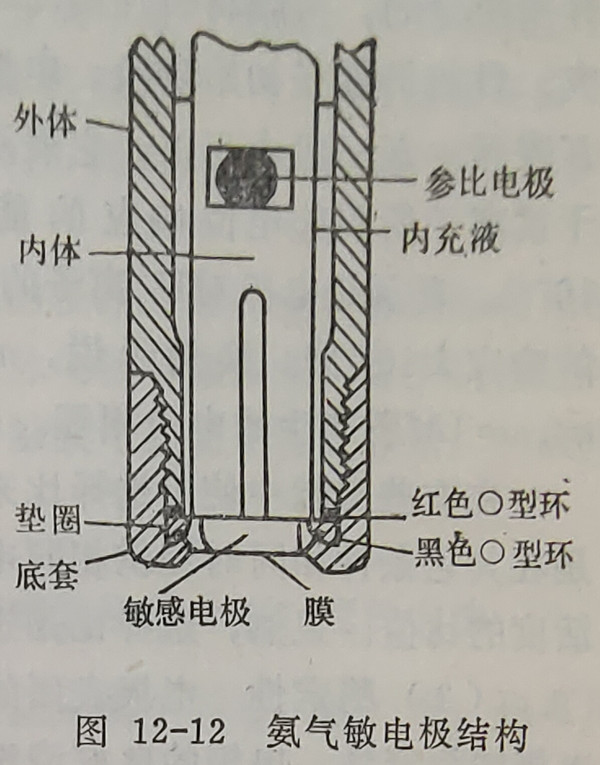
气敏电极是七十年代发展起来的一种新型离子选择性电极,属于复膜电极,能测定NH3、NO2、SO2、CO2等等。下面以氨电极为例加以说明。氨电极的结构如图12-12所示,电极内部一支平底的pH玻璃电极作为指示电极,浸泡在内充液中。内充液由0.01MNH4CI和惰性电解质如NaCl、KCl等组成。内充液与试液之间是用一层极薄的透气聚偏氟乙烯膜隔开。它只允许透过NH3气,而不允许溶液中离子通过。参比电极为Ag-AgCl电极,它是插入到气敏电极的内充液中,因此,它与气敏电极本身装在同一体内。
使用氨气敏电极测量时,当试液产生NH3气,通过透气膜扩散并溶于内充液时,则按下式进行反应。NH3+H2O《=》NH4++OH-
NH3、NH4+和OH-之间存在平衡关系,
(NH+)(OH-)=K
(NH3)
内充液中存在足够量的NH4Cl,所以,NH4+。可认为是不变的,因此[OH-]=[NH3]K'。由此可见,pH玻璃电 极指示内充液中(OH-)的变化,直接反映(NH3)的变化。其电位与CNHs)的关系符合能斯特方程式。
三、离子选择性电极的特性
(1)选择性离子选择性电极的选择性是由膜材料的本性所决定的,对膜材料性质与电极选择性之间的内在联系的研究,目前仍处在初始阶段。电极选择性的好坏,可用选择常数K表示。K一般小于1,它表示电极对同一溶液中被测离子和干扰离子所引起电位响应的能力的比较。例如,Kh+/Na+=10-11,表示此电极对Ha+离子的响应比对同样活度的Na+ 离子的响应大10 11倍。换句话说,ah+=10-11M所产生的电位与aNa+=1M所产生的电位相等。显然,选择常数越小越好。
在有些文献中使用选择比来描述电极的选择性。选择比就是在其它条件相同时提供相同电位的干扰离子活度和被测离子活度的比值。显然,选择比是选择常数的倒数。
(2)稳定性电极表面的沾污或物理性质的变化,影响电极的稳定性。电极的良好清洗,浸泡处理、固体电极的表面抛光等都能改善这种情况。电极密封不良,粘接剂选择不当,或内部导线接触不良等也导致电位不稳定。
(3)响应速度电极响应的速度对于连续监测是十分重要的。电极响应速度一般较快,有的电极甚至低于1分钟,一般也在数分钟以内。响应速度与测量溶液的浓度,试液中其它电解质的存在情况,测量的顺序(由浓到稀或者相反)以及前后两种溶液之间浓度差等都有关系。测定浓溶液后再测稀溶液,平衡时间较长,可能是膜表面吸附所致,用纯水清洗几次可逐渐恢复。
(4)温度和pH值范围每类选择性电极均有一定的使用温度范围,温度的变化,不仅影响测定的电位值,而且超过某一温度范围往往电极会失去正常的响应性能。电极允许使用的温度范围与膜的类型有关,一般使用温度下限为-5℃左右,上限为80~100℃。有些液膜电极只能用到50℃左右。
离子选择性电极的pH范围与电极类型和所测溶液浓度有关。大多数电极在接近中性的介质中进行测量,而且有较宽的pH范围。如氯电极适用的pH范围为2~11,硝酸根电极对
0.1M NO3-适用pH为2.5~10.0,而对10-3M NO3-时适用pH
为3.5~8.5。
(5)电极的寿命 电极的使用寿命随电极类型和使用条件的不同而有很大的差异。固体电极寿命较长,若周期性进行表面处理,可以使用较长期。液膜电极使用寿命较短,一般只有几个月或更短。
四、离子选择性电极测定离子活(浓)度的方法
离子选择性电极可以直接测定离子的活(浓)度,也可用以指示滴定终点。
1.电池电动势和离子活度之间的关系
与用pH玻璃电极测定溶液pH值一样,用离子选择性电极测定离子活度时也是把它插入被测溶液中,与参比电极组成一个原电池,并测量其电动势。例如,使用氟离子电极测定F-活(浓)度时组成如下的电池:
Hg Hg2Cl2, KCl(饱和) 试液|LaF3膜|NaF, NaCl,AgCl Ag。
其中φAgCl/Ag、K、φHg2CI2/Hg均为常数,可合并为一个常数K'
E=K'-0.059lgaf-
对于各种离子选择性电极,可以得出如下一般公式:
E=K'+0.059 lga阳高子
n
E=K'--0.059 lga阴离子
n
说明工作电池的电动势在一定条件下与被测离子活度的对数值成直线关系。




![2,2-双[4-(4-氨基苯氧基苯)]六氟丙烷](images/202103/thumb_img/3458_thumb_G_1615773264954.jpg)