(一)滴汞电极上的电解反应
在静止溶液中应用滴汞电极进行电解时,当外加电压逐渐增加时,滴滴求电极(阴极)电位逐渐变得更负;在未达到析出电位前,离子不能还原,只有微量的电流通过。当阴极电位达到析出电位时,继继续增加电压,则在滴汞电极表面溶中的离子很快被还原,接近电极表面溶液中的离子浓度很快下降,从而使电极表面和溶液之间产生了浓度差。因此,溶液中的离子逐渐向电极表面移动,这种现象叫浓差极化。由于滴求电极的面积很小(毛细管的内径只有0.03~~0.05厘米),因此电极表面的电流密度度是很大的,当电压继续增加时,电极表面离子浓度降低很快,以至趋近于零。这时电流的大小决定于离子由溶液向电极表面运动的速度。如继续增加电压不能使电流很快增加时,就产生极限电流。
(二)残余电流
在电解过程中,外加电压虽未达到该物质的分解电位,但仍有微量的电流通过,这种电流称为残余电流。残余电流是由两种原因引起的。其中一部分是溶液中痕量杂质,如溶解氧和汞带来的微量Hgt和Hg所产生的杂质。这些杂质在未达到被分析物质的分解电压之前,便在滴汞电极上还原,故这部分电流是法拉第电流其方向与阴极极化电流的方向相同。
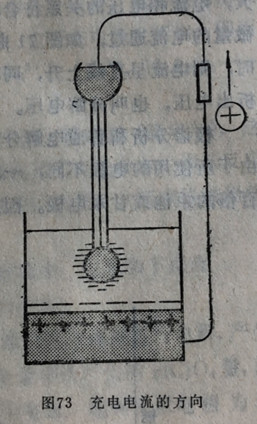 残余电流的另一部分为充电电流,它是由于汞滴的不断下落而引起的。因为当每一个带电荷的汞滴形成时,需要在汞上构成相当于外加电位的电荷的缘故。随着汞滴面积的增加,在外电路中,电子就必须依照汞滴表面为双电层的正方向,或负方向而由储汞瓶流入或移出,因此只要汞滴不断下以落就有充电电流产生。但当在零电点时,汞滴表面不荷电,故无充电电流。
残余电流的另一部分为充电电流,它是由于汞滴的不断下落而引起的。因为当每一个带电荷的汞滴形成时,需要在汞上构成相当于外加电位的电荷的缘故。随着汞滴面积的增加,在外电路中,电子就必须依照汞滴表面为双电层的正方向,或负方向而由储汞瓶流入或移出,因此只要汞滴不断下以落就有充电电流产生。但当在零电点时,汞滴表面不荷电,故无充电电流。
图73表示在外加电压为零时(即滴汞徽电极与阳极短路)的充电电流。在0.1NVKC1溶液中,当滴汞电极电位比零电点(-0.56伏)为正时,充电电流的方向与阴极极化的方向相反(负电流),它与上述的法拉第型电流相抵消一部分;当滴汞电极电位比零电点更负时,充电电流改变方向,它与法拉第型的残余电流叠加起来。因此,当滴汞电极电位较零电点为正时,残余电流较少;当外加电位比零电点更负时,残余电流较大
(三)迁移电流与支持电解质的作用
(1)迁移电流 在电解池上两极加电压后,可还原离子在滴汞电极上的浓度就迅速减少,因此滴汞微电极表面与溶液本体间就产生浓差梯度。由于可还原离子是带电荷的,所以在产生浓差梯度的同时,滴汞表面与溶液本体之间就有电位梯度存在。如果可还原离子为阳离子,带有正电荷,则溶液
本体比滴汞面具有较正的电位。推动可还原离子到滴汞表面有两种力,一种是由于浓差梯度产生的护散力,(另一种是由电位梯度产生的电场力。前者所产生的电流称为扩散电流,后者所产生的电流称为迁移电流(这是海洛夫斯基提出的名称)。由于只有扩散电流才与可还原离子浓度成正比,因而极谱分析应除去迁移电流。
图74示出了10-3 Mcdcl2在加入(a)0、(b)5、(c)10、(d)40、(e)80倍的KC1支持电解质中迁移电流曲线。
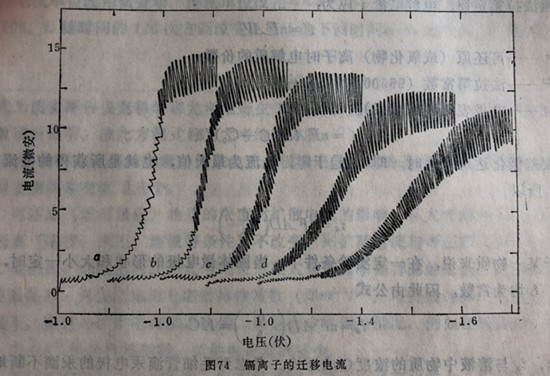
消除迁移电流的方法很简单,只需在待分析溶液中加支持电解质即可。所谓支持电介质,就是这些电介质具有很负的还原电位,它们在待待测离子可还原的电位下并不起反应,因而又称为惰性电介质。如上例的KC1以及NH4C1、KNO3、HCl、KoH……等。
(2)支持电介质的作用
a.消除迁移电流,即担负着99%(约100倍支持电介质)平衡电勢的作用。电场力对欲测离子的作用可以忽略不计。
b.支持电解质的加入,可增加溶液的导电度,减少溶液的电阻,即减少了溶液的电位降,能得到良好的极谱图。支持电介质过多,使溶液的“粘度”增加,降低灵敏度。
c.它与待测离子形成络合物,以改变半波电位,起到消除离子间的干扰作用。如在近中性溶液中,同时测定锌与镍是困难的。因为在近中性溶液中,锌与镍的半波电位各约为-1.06伏特及-1.11伏特,而在氯化铵及氢氧化铵溶液中,其半波电位各为-1.35伏特及-1.10伏特,可方便地测定。