










































酸一碱催化反应
一、酸一碱催化反应
许多催化反应按照酸一碱催化反应的机理进行。其中包括最重要的石油加工过程:催化裂化、异构化、烷基化、叠合,以及其他许多过程。酸一碱催化反应和氧化一还原催化反应的性质完全不同,这类反应活的化剂不是属于过渡元素,而是硼、磷,硫和那些具有强酸性质元素的化合物,或者是具有强碱性质铝、硅化反应于质子的化合物(见图5-13)。

在这类反应中有效的化剂是质子酸和质子碱,以及非质子对于有质子转移的酸催化反应,化活性决定于化剂给予反应物质子的难易,越容易给出质子的物质则催化活性越强,反之对于有质子转移的碱催化反应来说,使反应物给出质子能力越强的物质,催化活性也越高。在溶液里进行的均相酸一碱化反应,早在三十多年前就建立了酸和破的强度与化活性间的定量关系。质子酸给予质子的能力与离解常数Ka成正比:
AH+H₂O≒A¯+H₃O+
而酸催化剂的催化活性Ka(也可称做催化常数)又与离解常数Ka成正比,这样就建立了下面的关系式:
logKa=αlogKa+Ca
对于质子碱可以得到相似的公式
logKb=βlogKb+Cb
上边两式中的Ca、Cb和α、β为常数。这些常数取决于反应的类型和条件。因为酸与碱的离解常数(K)可以通过计算求出,因此在同一反应中测得几个催化剂的活性后,就可以预测另一个催化剂的活性。而酸和碱的离解常数决定于组成酸或碱的元素的电子结构。因而也就取决于这些元素在周期表中的位置。
对于固体酸碱催化的情况下,上述关系就不那么简单,还没有建立通用的计2算公式,复杂的原因在于,固体表面与反应物分子的相互作用,对反应途径和活化络合物能量产生额外的影响。尽管如此,仍然能观察到个别族的固体催化剂催化活性与酸性中心强度的联酸性与异丙烯脱水催化活性的关系。无定形二元氧化硅的酸性对醇类脱水和烯烃异构化催化活性的线性关系就是一个例子(图5-14)。

广义上讲非质子酸(也叫做路易斯酸)是电子的接受体。当将非质子酸用作化剂时,化剂与反应物分子间的相互作用,是靠未共享的电子对的参与而实现的。根据这些联系和化合物酸性质与元素电子结构的关系,就可以知道那些对酸碱催化具有高活性元素和化合物在周期表中的分布。元素的酸性和元素的电负性、两者在周期表中变化的方向是相同的,在同一周期中元素的电负性随原子序数的增加而升高,因而对酸催化反应来说,化活性也增加。在同一族中元素的电负性随原子序数的增加而下降,因酸催化活性也降低。对于碱催化反应,情况恰好相反。根据这个规律,位于第二周期末端的元素氟的化合物,对酸催化反应活性最高。对于碱催化反应来说,第Ⅰ族元素的化合物的活性最高。
酸性和化活性与元素在周期表中位置的关系,也表现在双组份催化剂中。以MeOSiO2组成的无定形催化剂,对异丙醇脱水的活性顺序如下:
Al₂O₃-SIO₂>Ga₂0₃-Si0₂>Y₂O₃-SiO₂>La₂0₃-Si0₂这个顺序与第二个氧化物酸性降低顺序Al₂O₃>Ga₂0₃>Y₂O₂>La₂0₃是一致的。
工业催化剂最重要的指标是单位体积催化剂的生产能力,而单位体积催化剂的表面积大小是决定生产能力的重要因素之一。
非常有意思的是制备和保持各种元素化合物的大的表面积,也与该元素在周期表中的位置有联系的。
金属化剂在高温下的稳定性随熔点的提高而升高。图5-14是周期表中第四、五、六周期中过渡元素的熔点与元素中d电子数的关系。在第六周期的熔点为17693℃,在铂重整过程中,铂化剂活性降低的主要原因是粒合并而変大,降低了工作表面。当加入Ir(215℃),Re(3180℃)等高融点金属时能够阻止品粒的烧结,目前出现的双金属Pt-Re、Rt-Ir、Pt-W等化剂可能就是根据这种规律寻找的。
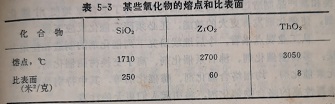
对于金属氧化物化剂,在低于半熔融的条件下,在周期表中同族内保持大表面积的能力随原子序数的增加而降低。这种关系在图5-15中表现得非常清断。图中曲线1和3分别表示族和重族的氧化物在800℃煅烧的结果,曲线2为在1000温度下般烧的结果。氧化物SiO2、2rO2和ThO2在1000℃0般烧后每毫升的表面积分别为250、60和8米/克,这个顺序和它们熔点的顺序恰好相反(表5-3)。
这样看来,氧化物在高温热处理下还能保持大的表面积,并不决定于氧化物的熔融温度,而是决定于这些氧化物其他方面的性质。例如可能氧化物中共价键的程度起着决定性的作用。而共价决定着化学键的空间定位,它又随原子序数的增加而降低。
因此便可以得出在实用方面非常重要的规律,即高温下能稳定地保持大的表面积,载体和化剂中应当含有周期表中第二和第三周期元素的氧化物。
本章简要叙述了化剂组成选择的某些定性规律。应当着重出,这些规律只适用于些具有相同反应机理的催化过程。因此要根据元素的电子结构,来解决化剂组成的选择问题,还必进一步开化反应机理的規律性以及反应物与催化剂间相互作用的本质。