工业催化剂的选择问题
三水锰矿 / 2021-08-03
第五章 工业催化剂的选择问题
随着石油化学工业的迅速发展,科学地选择催化剂越来越显得重要和迫切。近十几年来由于其他科学技术的发展,在催化剂的选择方面有可能采用更精密的测量仪器和现代的研究方法,因而取得了很大的进展。但是,至今还没有关于催化剂选择的统一理论。仅仅借助于在一般化学和物理学基础上总结出的某些局部规律,作为选择催化剂指导原则的重要参考。尽管这些局部规律用于选择复杂的工业催化剂时有很大的局限性,但能大大缩小过去筛选催化剂的工作量,从而节约人力和物力。不再像六十多年前德国化学工作者发现氨合成的第一个催化剂那样,曾经试验了两万来个配方。
选择适宜的催化剂,需要有两方面的知识,即所研究的化学反应的性质和固体物质的催化活性。本章将就这两个方面结合工业中经常遇到的问题予以简要叙述。
第一节催化剂选择的前提
工业中选择催化剂可视其性质大致分为三个方面:不断改进现有催化剂的性能;利用现有原料合成有用的产品而寻找催化剂;制备具有某种指定性能的新产品而研制催化剂。
一、现有催化剂的改进
改进现有工业生产中催化剂的性能,对那些大吨位的产品来说是一项重要工作。这些工作主要包括提高催化剂的活性和选择性、延长寿命、寻找廉价的催化剂的原料、降低操作温度、压力以及简化催化剂的制备工艺等。
进一步提高化剂的活性对许多老产品的生产来说有重要意义。例如对于一个年产30万吨合成氨工厂,如果能在相同的条件下将催化剂的活性提高1%,就意味着能增产3000。对于由烃类氧化制取含氧化合物来说,提高催化剂的选性具有重要意义。因为在氧化过程中,如果副反应和深度氧化反应受到抑制,就会提高所需要产物的收率。由乙烯氧化制取环氧乙烷、丙烯氧化制丙烯醛和丙烯酸以及由丙烯氨氧化制丙烯等是这类代表,例如索亥公司由丙氧化生产丙,1年投入工业生产的第一个催化剂为磷钼系,每吨丙烯消耗两烯1.4吨,1966年发展的铀一锑系催化剂使丙烯消耗降到1.25吨到了1972年又发展了种新型锑一铁系催化剂,又使丙烯消耗继续下降到1,1吨以下。根据目前的发展来看,不久将出现选择性更高的催化剂,将可能使丙烯的消耗定额降到1吨以下。大吨位工业用催化剂,就是这样一代一代的进行更新。
延长化剂在工业装置中的使用期限,是许多工业催化剂的改进方向。这不但可以减少投资,而且还由于减少了催化剂的更换时间而提高生产能力。
许多工业催化过程使用贵金属催化剂,寻找廉价的原料来代替这些贵金属对降低生产成本具有重大意义。用铂网催化剂使氨氧化生产硝酸时,每吨硝酸消耗70毫克以上的销,对一个年产10万吨的硝酸工厂,每年至少要消耗7公斤的金属。用钯化剂由醋酸和乙烯生产醋酸乙烯时,对一个年产6万吨的醋酸乙烯工厂,需要56米的催化剂,约合300万元。
对于合成氨、一氧化碳与氢气合成甲醇以及苯加氢生产环己烷等放热可逆反应,应研制在低温下仍具有足够活性的催化剂。因为降低操作温度能够提高平衡转化率。
二、利用现有原料研制催化剂
在煤化学中,从乙炔出发经过催化加工可制得一系列产品。当化工产品原料逐步由煤转向石油、天然气过程中,则要求研制系列新型催化剂来适应石油和天然气的催化加工。以天然气为原料合成氨时,要用加氢脱硫催化剂,蒸汽转化催化剂,中、低温变换催化剂,甲烷化催化剂以及氨合成催化剂。过去以煤为原料的合成氨工业用的催化剂,就远远不能满足需要,还必须引入加氢脱硫和蒸汽转化等催化剂。由石油裂解可得到大量的乙师、丙都和碳四惯份,要利用这些康价的原料生产各种各样的化工产品,就必须研制适应这些过程的催化剂。五十年代末以来丙烯腊、乙醛、醋酸乙烯、氯乙烯等几个乙炔化学的主要产品转向以乙烯、丙烯等石油烃裂解分离产品为原料,丰富的石油资源开发为此提供了条件,而适应这些过程研究开发了磷钼铋、氧化钯、氯化铜等新型催化体系则使这种原料路线转变成为可能。
在工业生产中常常为利用经济价值不大的副产物,或解决环境污染问题而寻找新的催化剂。
三、为制备具有指定性能的产品而研制催化剂
在基本有机合成、塑料、合成纤维和合成橡胶工业中,经常要求提供能合成具有特定性能产品的催化剂。例如,生产醋酸可用乙炔、乙烯、丁烷、轻油或甲醇和一氧化碳为原料,用不同催化体系通过不同的路线进行合成。再如,为了解决人民的穿衣和工业用纤维问题,发展合成纤维工业有重大作用,其中原料的生产是个关键。以聚酯纤维用对二甲苯的生产为例,目前除了直接从轻油催化重整和裂解汽油馏份分离对二甲苯外,还采取相应的催化方法将甲茉、邻二甲苯、间二甲苯、三甲苯、甚至乙苯转化成对二甲苯:
(2)甲苯和三甲苯发生烷基转移反应生成混合二甲苯;
(4)邻二甲苯和间二甲苯异构生成对二甲苯。
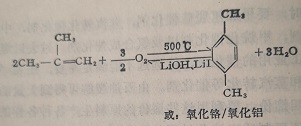
此外,还研究一些新的反应来扩大对二甲苯的来源,例如用异丁烯在氢氧化锂和碘化理或氧化铬/氧化铝催化剂上环化、氧化脱氢生成对二甲苯。
高分子合成材料的性能决定于它的化学组成和结构。天然胶和纤维等高分子化合物,经过人们剖析得知,它的结构元都是有规则的,如天然橡胶就是规整排列的顺式-1,4一聚异二所以具有很好的弹性。从此以后,人们致力于寻找合成顺式-1,聚异戊二烯的化剂,终于找到了能够定向聚合的新型催化剂一氯化钛和烷基铝。由过渡金属化合物和有机金属化合物构成的化剂体系统称为齐格一纳塔型化剂。可以说,没有定向聚合化剂的发现,合成橡胶和塑料工业能有今天这样大的发展是不可想象的。
在这方面,人们将越来越多的需要各种具有特定性能的高分子化合物,为了合成这些材料必须研制适应各种过程的催化剂。
四、催化反应的热力学考察
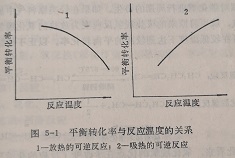
在誉手研制已经确定的反应的催化剂之前,应当对该反应进行热力学上的考察。关于这一点,不论是寻找新反应的催化剂还是改进现有的催化剂都是重要的。这是因为应当知道在某一定的反应条件下(温度、压力、浓度等),被研究的反应能不能进行,以及能进行到什么程度,也就是说可能达到的最高转化率是多少。对于可逆反应,热力学的讨论意味着在一定条件下该反应可能达到的最高转化率,就是平衡转化率。对任何已知反应的平衡转化率可从理论上计算出来。对于不可逆反应,就意味着反应物可以完全转化为产物。此外,对放热的可逆反应,平衡转化着反应温度的升高而降低;对吸热的可逆反应,平衡转化率则随着反应温度的升高而增加(图5-1)。
在工业上比较重要的放热可逆过程有氨的合成、一氧化碳水
蒸汽变换、接法生产硫酸、合成甲醇和乙醇、烯烃的加氢等。这些反应在低温下具有高的平衡转化率,因此研制低温下活浚的化剂是具有重要意义的。目前很多人在研究低温合成氨的催化剂,有人发现一种活泼的EDA化剂,甚至在纸于100℃时能够进行氨的合成反应。一氧化碳低温变换氧化铜一氧化锌系催化剂,可使反应在230℃左右进行,而通常的Fe2O-Cr2O催化剂需要在350~500℃オ有活性。由于变换温度降低100℃多,大大有利于氧化碳的转化,使出口气体中一氧化碳的含量小于0,35%。低温变换铜一锌系催化剂的研制成功,使有可能用甲烷化催化剂来代替铜氨液吸收脱除CO,从而简化了氨的合成工艺。
由CO和H2可以合成甲醇,或深度加氢(甲烷化)生成甲烷和水:
为了生产甲醇,要求催化剂具有足够的活性和选择性。而甲烷化则生成非常稳定的产物甲烷和水,这时仅要求催化剂具有足够的活性,而对催化剂选择性则无所要求。
过去半个世纪以来,一直采用ZnO-Cr2O3系催化剂高压法合成甲醇,合成压力为250~300大气压,温度为400℃。之所以用如此高的压力,是因为ZnO-Cr2O,系催化剂只有当度高到400℃左右时才表现出有足够的活性,而且在这样高的下,若不采取高压法生产,甲醇的平衡转化率就很低,以致工产是不经济的。当研制出在低温具有活性的CuO-ZnO系后,使合成甲醇的操作压力降低到50大气压,这就是合成甲称的低压法。低压法比高压法的生产成本约低10%左右。
对于吸热的可逆反应,工业上重要的有烃类的催化脱氢和石脑油化重整等过程。从热力学的分析可知,烃类的脱氢反应只有在相当高的温度下才有较大的平衡转化率。由于烃类在高温下的不稳定,脱氢反应不可避免地伴随着一些副反应,因而导致选择性下降。并且由于炭在催化剂表面上的沉积使活性迅速下降,故必须对催化剂进行周期的再生。如果在烃类原料气中加入氧气或空气,就可将原来的吸热脱氢反应变为放热的氧化脱氢反应。后者可在较低温度下达到较高的平衡转化率。以正丁烯脱氢反应为例:
脱氢反应:
氧化脱氢反应:
由此看来,氧化脱氢的优点在于改变了反应的化学平衡,在较低温度下具有较高的平衡转化率;催化剂不需要进行同期的再生。正丁烷脱氢制丁二烯、异戊烷和异戊烯脱氢制异戊二烯和乙苯脱氢制苯乙烯,都可以采用氧化脱氢的原理。工业上乙烯氧氯化法生产氯乙烯、丙烯氨氧化法生产丙烯腈等过程都改变了反应的化学平衡,发展成有意义的工业生产过程。
2CH₂=CH₂+Cl₂+½0₂→2CH₂=CHCl+½H₂0
CH₂+CHCH₃+NH₃+1½O₂=CHCN+3H₂0
为了避免氧化脱氢反应释放出大量的反应热,可以用氧化脱氢剂SO2来代替O,这时对于烷烃的脱氢进行如下的反应
3CnH₂n+₂+SO₂→3CnH₂n+H₂S+2H₂O
该反应释放的热量只有2~3千卡。而反应中生成的HS很容易氧化为S₂。这样烷烃的脱氢反应可以得到较好的收率。
由以上的热力学分析可见,要选择一个适用的催化剂,首先要有关于化学反应本性和固体催化活性的知识。因此有必要对化学反应进行简要的分类,以便讨论催化剂的选择问题。
五、催化反应的分类
在以后的各章里,按化学工业的专业简要地介绍一些重要的催化反应和所采用的催化剂。这样能够给读者一个关于工业中应用的催化剂的完整概念。但当讨论催化反应及其适宜的催化剂时,就必须在化学性质上对催化反应进行分类。
1.氧化还原反应
加氢-脱氢,氢交换(岐化作用),加氢裂解,氧化脱氢,加氧(加硫),燃烧。
2.取代反应
卤化,氨化,水解。
3.加成一消除反应
水合一脱水,氢卤化,氢硫化,氨化,羰基化,羧化,烷基化,缩合一解聚,聚合;以及这些反应的逆反应。
4.环化反应
芳构化(脱水、脱氢硫基等),闭环为酸酐、环醚类、硫化物、亚胺类。
5.分子重排
重键转移,分子骨架异构化,环的缩小和扩大。
根据对多相催化反应机理的分析可知,氧化还原反应为本身也是氧化还原体系的固体所催化,而取代反应、加成一消除反应、环化反应和分子重排反应为酸碱催化剂所催化。这样就将催化反应分为两大类;氧化一还原催化反应和酸一碱催化反应。








.png)
CS[6Q2H.png)