液体的干燥
化学试剂,九料化工商城 / 2020-11-22
干燥的意义
干燥系指除去附在固体、气体或混在液体内的少量水分,也包括除去少量的溶剂.在有机化学实验室中,干燥是最普通而又很重要的一项操作,虽然操作简单,但若做得不合要求,无论在反应过程中或纯化产品时,都会影响结果.在合成实验中,要求非常干燥的情况很多,不仅所用的原料和溶剂需要干燥,而且还要防止空气中的水分进入反应中.例如,制备格氏试剂时,通常要求在无水、无醇的干燥乙中进行,为了防止湿气和二氧化碳侵入,还必须安装钠石灰干燥管,因格氏试剂易被水解为烷烃:
OH
RMgX+O2H→RH+Mg<
X
或与二氧化碳发生加成反应:
R
RMGX+CO2→O=C<
OMgG
又如,制备酰氯亦要求在干燥条件下进行,如有水分存在,酰氯就会水解成为羧酸.干燥对有机化合物的纯化也很重要最常用的纯化方法是蒸馏和重结晶.若干燥不好,在蒸馏过程中,可引起某些物质分解或与水形成共沸混合物;在重结晶时,也会使有些化合物因吸湿而得不到满意的结晶.此外,从结晶母液滤得的晶体,其上附有溶剂,亦应采取适当的干燥方法将它除尽,否则也会影响质量.尤其应注意的是,在分析化合物之前,必须完全干燥,有时还要除去其所含的结晶水或结晶醇,否则将影响分析结果.因此,对干燥操作必须严格要求,认真对待.
液体的干燥
(一)利用生成二元共沸混合物的方法,除去少量水分或溶剂:许多与水不相溶的溶剂(除乙醚外)可与水形成二元共沸混合物,其共沸点均低于该溶剂本身的沸点(见表2,5.1)当混合物蒸馏完毕,即剩下无水溶剂.此法还可应用于除去反应过程中生成的水分或醇(例如酯化反应),以达到提高产率的目的.
最常用的溶剂是苯或甲苯操作时,一般蒸馏至出液不呈混浊即可.或装上高效分馏柱,当温度升至该溶剂的点时,即可收集到无水溶剂.
使用干燥剂去水
1.干燥剂的分类:干燥剂按其脱水作用可分为两类.
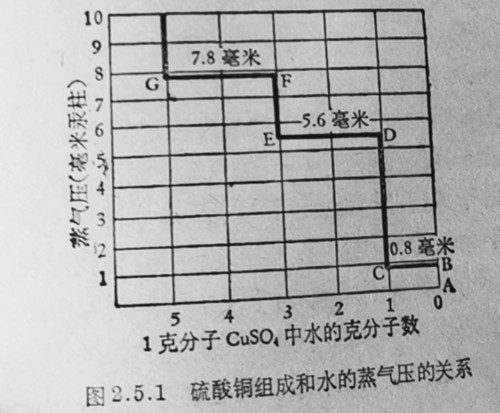
(1)与水可逆地结合生成水合物,如硫酸、无水氯化钙、无水硫酸钠、无水硫酸镁、无水硫酸铜、无水硫酸钙、固体氢氧化钾(或钠)以及无水碳酸钾等.此类干燥剂不可能完全去水,因水分在干燥剂与被干燥液体之间存在着平衡.以无水硫酸铜为例,在装有压力计的真空器皿中,放置一定量的无水硫酸铜,保持温度25C,慢慢通入不同克分子数的水蒸气,结果得到不同的蒸气压力、以水蒸气压力和通入的水克分子数作图(见图2.5.1),A点为起始状态,硫酸铜为无水的,当慢慢通入水蒸气后,水蒸气压力直线上升至B点,此时生成带有一个结晶水的硫酸铜水合物(CuSO4▪H2O).在此情况下存在着两种固相:CuSO4和CuSO4・H2O虽连续通入更多的水蒸气,但压力计上所示的压力仍保持恒定(BC-0.8毫米汞柱)到C点,原来的无水硫酸铜已全部转变为带有一份结晶水的硫酸铜水合物、此时水蒸气压力始沿CD线上升,直至D点形成带有三个结品水的水合物(CuSO4▪3H2O).在此情况下,压カ又保持一段时间恒定(DB-5.6毫米汞柱),同时,存在着两种固相:CuSO4▪3H2O和CusO4▪H2O.直至E点,带有个结晶水的硫酸铜水合物全部转变为带有三个结晶水的水合物时,压力又重新开始上升至F点,形成五个结品水的硫酸铜水合物(CuSO4·5H2O),系统压力又保持恒定.这种现象可用三个平衡式来表示:
Cuso4+H2O4→←Cuso4▪H2O
Cuso4▪H20+2H2O→←Cuso4▪3H2O
Cuso4▪3H2O+2H2O→←Cuso4▪5H2O
从上述情况说明,用不同量的干燥剂能达到不同的干燥程度,另外,当温度保持在50C时,则其蒸气压分别为4.5、30.9及45.4毫米汞柱;当温度升至102℃时,带五个结晶水的硫酸铜(CusO4▪5H2O)已经不稳定了,容易失水,形成较稳定的三个结品水的硫酸铜水合物(CusO4▪3H2O),这说明温度升高,干燥效率则降低.任何带有不同结晶水的水合物在平衡状态时所显示的蒸气压均随温度的升高而增大,再以氯化钙为例(见表2,5.2),同样可以见到。温度越低,干燥效率越高、因此,在进行蒸馏之前,必须先将此类干燥剂滤除干净。
(2)与水作用生成新的化合物,如五氧化二确、氧化钙和金属钠等,它们与水发生不可逆反应:
CaO+H2O→Ca(OH)2↓
Na+H2O→NaOH+H2↑
这一类干燥剂加入液体后,蒸馏时可不必滤除.
在制备无水乙醇时,单用金属钠并不能完全去除乙醇中含有的少量水分,因乙醇钠与水的反应是可逆的.
C2H5ONA+H2O→←NAOH+C2H5OH
因此必须加入邻苯二甲酸乙或瑰珀酸乙酯,使上述的平衡反应向右移动(详见常用有机溶剂的纯化一节),方能制得含水量低于0.01%的无水乙醇.
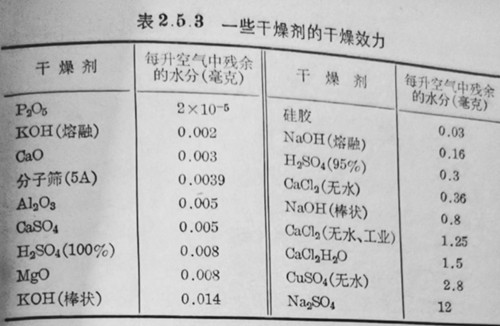
2.干燥剂的效力:干燥剂的效力可用一个很粗的方法来比较.即在一定温度及流速下,通入1升相同湿度的空气,经过定量的干燥剂,其后测定空气中残余水蒸气含量,含量愈高则表示于燥剂的效力愈差.但必须指出,在实际使用时,还有一些因素可能影响干燥效力,例如,干燥剂的用量、干燥时的温度、干燥的时间以及被干燥物质的理化性质等,此外,干燥液体与干燥气体所得的结果也往往相差很大.因此,欲比较干燥剂效力的大小,目前尚难做出合适的结论,现将文献报道的结果归纳于表2.5.3中,以供选择时参考.
干燥有机溶剂时,不但依靠所用的干燥剂性能及效力,而且还与液体中的含水量有关(见表2.5.4).选择使用干燥剂时,不能单考虑干燥剂的效力,还应同时注意下列各点:
(1)不与被干燥的有机物发生任何化学反应,若引起水解、分解、变色、酸碱中和以及生成分子化合物等均不能用;
(2)不溶于该有机物中;
(3)对被干燥的有机物无催化作用。
(4)干燥速度快,吸水量大,价格低廉。
3.常用的干燥剂:
(1)无水氯化钙(CaCI2),为最常用的液体和气体的干燥剂.价廉、吸水能力较大、在30℃以下能形成带六个结晶水的氯化钙(CaCI2▪6H2O),但作用不快,平衡速度慢,所以用无水氯化钙干燥液体需放置一段时间,并间歌振摇.工业制得的无水氯化钙含有一些氢氧化钙和碱性氯化物,因此不适用于酸性液体或酸类的干燥,同时,氯化钙又能与醇类、酚类、酸类、胺类、氨基酸、酰胺、酮及某些醛和酯形成分子络合物,因此,也不能作为上述各类化合物的干燥剂.
(2)无水硫酸镁(MgSO4),是一个很好的中性干燥剂.效力中等,作用快,吸水量较大,能形成带七个结晶水的硫酸镁(MgSO4▪7H2O),与有机物不起化学反应.在25℃时MgSO4▪H2O,蒸气压为1毫米汞柱;MgSO4▪2HO,蒸气压为2毫米汞柱;MgSO4▪4H2O,蒸气压为5毫米汞柱.硫酸镁可干燥许多不能用氯化钙干燥的有机化合物,如酯、醛、酮、和酰胺等.
(3)无水硫酸钠(Na2SO4),是中性干燥剂.价廉、吸水量较大、应用较广但其作用慢,干燥效率差.当有机物夹杂着大量水分时,常先用作初步干燥,以除去大量水分、然后再用效率高的干燥剂于燥,在2.4O以下,吸水后形成带10个结品水的硫酸钠(Na2SO4▪10H2O),超过此温度则此水合物不稳定.
(4)无水硫酸钙(CasO4),是一种作用快、效率高、应用较广的干燥剂.与有机物不起化学反应,且不溶于有机溶剂中;与水形成相当稳定的水合物(2CaSO4H2O),25C℃时蒸气压为0.004毫米汞柱.唯一的缺点是吸水量小(吸水量为其重量的6.6%).一般应用于第二次干燥(即在无水硫酸钠、无水硫酸镁或碳酸钾干燥后使用).如所干燥的溶剂沸点低于100℃,蒸馏时,事先可不必滤除用于千燥甲醇、乙醇、丙酮、乙醚、甲酸和乙酸等,可得到良好的效果。
(5)无水硫酸铜(CusO4),是干燥效率相当弱的干燥剂在25℃以下,能形成带五个结晶水的硫酸铜(CuSO4▪5H2O)制备无水酒精时,可用以鉴定是否含水,若变蓝则表示有水分.优点是可再生.当加热至10℃时,即可除去四个结晶水.
(6)无水碳酸钾(K2CO3),干燥效率中等,能形成带二个结晶水的碳酸钾(K2CO3▪2H2O),通常应用于水溶性醇和酮的初步干燥.有时可代替金属钠或氢氧化钠干燥胺类,或代替无水硫酸镁使用.不能用以干燥酸类、酚类或酸性物质.
(7)固体氢氧化钠(NaOH)或氢氧化钾(KOH),是强碱只能干燥氨气和胺类物质(也可用石灰、碱石灰和氢氧化钡进行于燥).氢氧化钾吸水能力较氢氧化钠大60-80倍.如被干燥的物质含水量大,或某些有机碱在无水状态下吸湿性很强,可先用作初步干燥,然后再用更有效的干燥剂干燥.不能用于干燥酸类、酚类和酰胺类(九料化工https://www.999gou.cn/).
(8)浓硫酸(H2SO4),可干燥溴、烷烃和卤代烷、干燥时置分液漏斗中振摇后分离.硫酸具有氧化性,限制了它的应用.
(9)五氧化二磷(P2O5),是所有干燥剂中干燥效力最高的干燥剂,作用非常快,但价钱贵.用它干燥时应先用无水硫酸镁或无水硫酸钠去水,否则成糖浆状。可用于干燥烷烃、代烷、芳烃卤化物、醚和腈;但不适于干燥醇类、酮类、有机酸和有机碱.
(10)氧化钡(BaO或氧化钙(CaO),为碱性干燥剂.与水作用后生成不溶解的氢氧化物,对热稳定、不挥发,故在蒸馏前不必滤除.用于千燥低分子的醇或吸湿性很强的有机碱(如吡啶等).但不能用于千燥酸性物质或酯类.实验室多用氧化钙,因价廉、来源方便.
(1)金属钠,可作惰性有机溶剂的最后干燥(如苯、乙醚、石油醚等).若被干燥的物质含水量较多,则需先用无水氯化钙或无水硫酸镁干燥,然后再用.凡是能与金属钠、碱作用或能被还原者均不能用,如不能用于干燥醇(做无水甲醇、无水乙醇等除外)、酸、酯、有机卤化物、、醛与某些胺.
使用干燥剂时应注意用量适当,否则不是干燥不完全就是使一部分物质吸附在干燥剂表面而造成损失.实际操作时,可先少加一些,振摇放置片刻后,如干燥剂有潮解现象可再加一些,或将上清液倾入另一瓶中,再加些干燥剂,作第二次于燥.









.jpg)
.jpg)
.jpg)
.jpg)