化学研究中的系统方法自组织问题
化学先生 / 2019-08-21
化学中许多过程无疑比物理过程要复杂得多。例如,多相催化过程,像在铂催化条件下氨氧化制硝酸,在氧化铜表面催化情况下使N2O分解,还有燃烧、酶催化等都是十分繁杂的过程。对这些过程以前多是经验性的解释,缺乏机理性的说明。
为了探讨上述问题,普利高津等人首先讨论了从化学平衡向化学非平衡的转化,这是对化学思想方法的发展,是一个突出的贡献。为了说明上述问题,试讨论下面这个一般的反应形式:
k
A+B→C+D
式中反应物A和B在一定条件 下生成C和D,其中速率常数k,一般是温度与压力的函数。上述反应开始以后,反应物A和B随着时间的推移而减少,而C和D随着时间的推移而增加。上式的逆反应为:
k'
C+D→A+B
如果在一个孤立体系中、经过足够长的时间以后,共存的四种物质A.B.C.D的数量将保持一个固定的比例.此时,我们就说体系达到了化学平衡,可以求得平稳常数:
k'
K=一
k
达到平衡的反应式如下:
k
A+B?C+D
k'
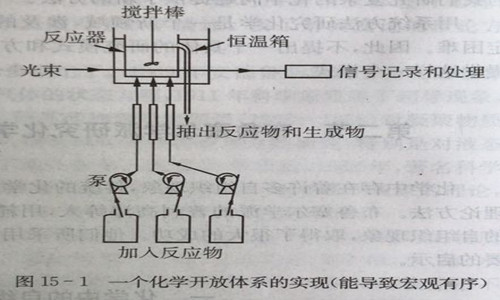
反应达到化学平衡以后,反应物和声物的浓度都不随时间变化,这在化学中已作为常识被接受下来,并形成了一种传统的观念。但是,普利高津等人则从这种情况中看出了问题,他们指出,上述反应如在开放体系中则完全是另一个样子。为此他们设计了一个上述反应的开放体系,如图15一1。
上述反应体 系有物质流的流人(反应物A、B)和流出(产物C、D),我们控制流人和流出的量就可以创造一种条件 使体系达到一种状态 ,在这种状态下,反应体系中A、B、C、D的浓度不随时间变化而保持恒定,但是它们之间浓度的比例,再也不是由平衡常数K决定,而是因为体系开放以后重新组织起来了。从数学意义上说,A、B、C、D浓度随时间的变化率为零,写成浓度的时间导数如下:
dCA dCB
一一=一一=…=0
dt dt
上述状态是一种“非 平衡定态”,它和封闭体系反应的平衡态有本质的不同:平衡态如改变浓度.压力、温度等,反应体系将按照勒夏特列原理自发地重建平衡非平衡定态则不然,它可以在物质(或能量)流人或流出中,完全建立一种新的秩序(宏观上的有序结构等》,如它可以使正反应速率远远大于逆反应速率面大量形成产物、反过来也可以。也就是说,这种开放体系能促使物质运动的变化,平衡态则无力做到这一点。
普利高津等人的思想方法有重要意义。 事实上,几个世纪以来,化学家在实验室中设计的化学反应体系,多半是一种闭合的体系.所以。那些化学变化无论经过多少步骤,一种类似于平衡态的均匀的、不随时间变化的状态总要出现。而真正的现实井不是这样,在自然界的化学进化和生命起源与发展中,绝大部分体系都不是封闭体系,而是开放的,正因为这样,世界才能通过化学来进化。
普利高津等人不仅用开放体系的思想方法成功地解释了化学进化,还成功地解释了以下问题:
⑴自催化问题。认为某产品可以增大其反应速率,和体系中各要素相互作用与按照一定的方式流通有关,这种自催化过程只有用非平衡的理论才能说明。
(2) 燃烧过程。布鲁塞尔学派认为,在燃烧过程中,由于含有未成对电子自由基的存在,自由基通过与其他分子反应而进- 步产生更多的自由基,因而雪崩式地加速反应,形成燃烧。对于这一过程,只有非平衡化学方法才能对其机理做出正确说明。
(3) 生物化学与自身繁殖。普利高津认为,这是一个复杂的自组织、自催化的过程。平衡态是不会出现这种情况的。生命化学中,遗传物质因特种蛋白质(酶)的介人而被复制,它们按照保存在遗传物质中的指令进行自我合成,这种过程只有用非平衡自组织的理论方法才能说明。