![1,8-二氮杂二环[5.4.0]十一碳-7-烯](images/201812/thumb_img/1103_thumb_G_1545291985569.jpg)




Be的电子结构是1s22s2,看来似乎是Be原子在其基态应根本不能生成共价键。不过在激发态下,1个2s电子可以升级到个2p轨道中去,使电子结构成为1s22s12p1,这表明有了2个成单电子可用于同能共用电子的原子形成共价键。
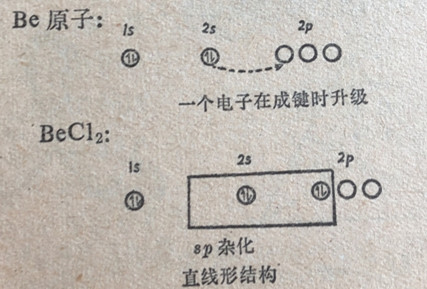
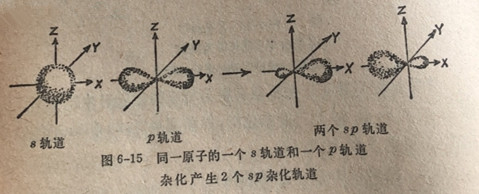
在气态中BeCl2是一个直线形分子,C1-Be-Cl1。全部3个原子都在一条直线上,两个Be--Cl键有相同的键长和强度,因此2个Be-CI键是等性的。在这里假设2s和2原子轨道发生杂化形成2个8?杂化轨道。这两个8p轨道同来自氯原子的轨道发生重叠形成o键。由于铍原子仅形成2个共价键,而且没有孤电子对,两个8p轨道的轴彼此分离的最大角度应该是180°(图6-1和6-15),这和测定值是一致的。由于这样的空间取向,8p杂化轨道也叫做直线杂化轨道,它总是和直线形结构相对应的。