









上面所述的方法为判断分子中原子的空间排布提供了一种手段。不过它对一个给定的键的键级并不能提供任何说明(参见第5.15节),也就是说,它不能指明这个键是由一对共用电子(单键)2对共用电子(双键)还是3对共用电子(参键)组成的。由于关于这三种类型价键是有很多例子的,这就引起了一个问题:怎样确定一个键究竟是单键、双键、还是叁键。做这项工作往往需要绘出价电子式(常叫做路易斯式),对每个原子都用价电子符号。
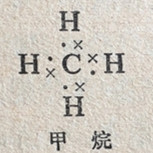
举例来说,在甲烷的路易斯式中,总共有8个价电子,给每个氢原子提供了2个电子的完整结构和给碳原子提供了8个电子的完整结构,因此每个键只可能是由1对电子组成的单健。
在二氧化碳分子的情况中,它是16价电子结构的,路易斯式给我们指出给毎一个原子完成价电子八隅体结构的唯一途径是通过使用双健,每个双键包括2对电子:
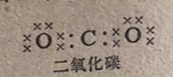
在乙烯C2H分子中有12个价电子,在两个碳原子间必须有个双键和每个碳原子和氢原子间有一个单键。

对乙炔来说,C2H2为10个价电子结构,碳-碳键必须包括3个电子对,和每个碳一氢键包括1个电子对,以便使每个氢原子完成2电子完满结构和每个碳原子完成8电子结构。
