





























包林( Linus Pauling)在1935年提出了价键理论,它假定不等性的原子轨道可以杂化(组合)产生一套等性轨道,这种杂化轨道的特征取向决定了分子或离子的几何结构。虽然这个理论使用了原子轨道而不是分子轨道,它在判断分子结构方面仍然是特别有用的。下面介绍一些特定化合物的若干例子。
每一个原子轨道可以容纳2个自旋相反的电子子。我们在前面已经学过(第3.17节),在各给定类型的轨道中,在出现电子配对之前,电子成单地进入各轨道(洪特规则)。于是,碳原子在正常状态(基态)中仅有2个成单电子,它的电子结构是1s22s2p12p2。根据这个结构,人们将会预期碳原子仅能形成两个共价键,有时确也如此。不过碳的的二价化合物并不象四价化合物(有4个共价键)那么普遍。我们可能会问,碳怎样能获得4个成单电子并用它们去形成4个共价健呢?这个问题的答案是:碳原子把2s轨道中的1个电子升级(激发)到第三个2p轨道里去,取得的电子结构是1s22s12p12p12p1。应该注意的一点是电子升级所需要的能量被价键形成时释放出来的能量所抵消而有余。于是,在电子升级和价键形成之后的能量状态要比这两步之前较低;能量的降低相对应于一种较为稳定的状态。
碳原子在其基态和电子升级后的电子分布可以用下面的图式表示出来,在其中用小圆圈代表各原子轨道和用箭头代表电子;在一个轨道中2个方向相反的箭头代表2个相反自旋的电子。

三个p轨道在空间的取向是彼此互成90°角(参见第3.20节);S轨道没有方向性,因为它是圆球形的。
在形成甲烷分子时,同碳以共价键相结合的4个氢原子各向碳原子的原子轨道(各含有1个成单电子)提供1个电子(各用黑体箭头表示)
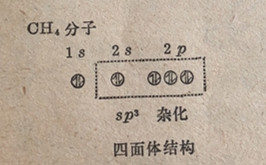
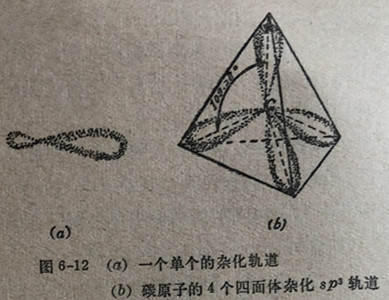
实验事实指出,甲烷的四个键在键长和键强度上都是相等的,并且它们都指向一个正四面体的角顶。根据量子力学计算,碳原子的一个2s轨道和3个2轨道杂化(组合)起来形成4个新的杂化轨道,它们彼此都是完全等同的,在空间的排布正好是使它们的突出部分指向一个正四面体的角顶顶(图6-12)。它们被叫做sp3杂化轨道,用以标志一个s轨道和三个p轨道的杂化;sp3杂化总是使分子形成四面体构型。
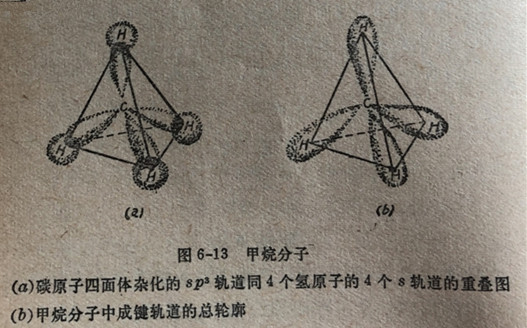
可以认为,甲烷分子的4个氢原子的各18轨道同碳原子的各sp3轨道发生重叠形成sp3-s键。请注意这种重叠和产生分子轨道的重叠(参见第5.1节)之间的类似性。这样重叠的结果在碳原子和4个氢原子间就形成了四个极强的共价键以产生甲烷分子CH4(图6-13)。
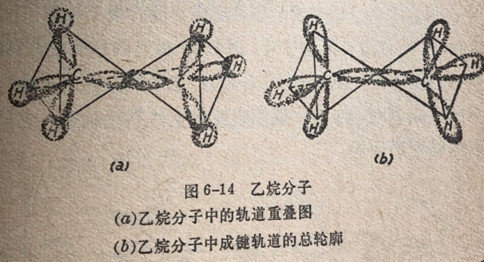
在乙烷C2H6中,碳原子的一个sp3轨道同另一个碳原子的sp3轨道以头碰头的方式互相重叠形成一个o键。碳原子的另坐
的三个sp3轨道与氢原子的1s轨道重叠形成外加的o键。乙烷是的结构和成键轨道的总轮廓绘示在图6-14中。乙烷分子是由共
用一个角顶的2个四面体构成的。
杂化过程只能在有关轨道有极为相近的能量时才能发生,2s和2p或者3s和3p是可能杂化的,但举例来说,2s和3s不能发生杂化。