








原子是由原子核和核外电子组成的.原子核外电子的总数正好和核所带的正电荷数(也就是核内质子的总数)相等,因而整个原子不显电性.那么原子核外的电子是在绕核迅速运转着的,为什么外电子能够绕迅速运袋呢?这是因为电子都具有一定的能量.如果电子的量较小,它只能在离核较近的地方运转,如果电子的能量较大,它就能在离核较远的地方运转。在含有较多电子的原子里,常有一些电子的能量较低,另一些电子的能量较高,它们分别在离核远近不同的地方绕核迅速运转,下面我们把几种简单原子的核外电子运转情况,根据核内质子数的顺序,扼要介绍如下:
最简单的是氢原子,原子核内只有1个质子(即1个单位的核电荷),核外也只有1个电子.在一般情况下,这个电子的能量小,它在离核较近的地方绕核运转,我们一般用图36(4)来描述氢原子的结构。
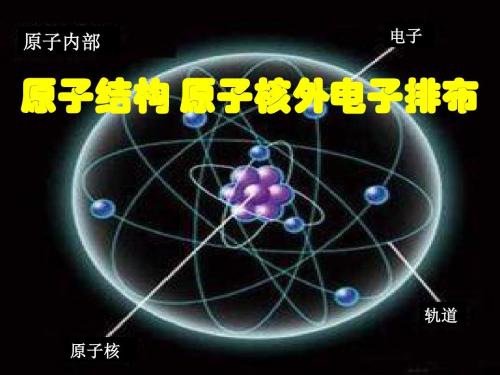
其次是氮原子,它的原子核内有2个质子,核外有2个电子,这2个电子的能量大致相同,它们以差不多相同的距离绕核运转,我们们说这2个电子是在同一个电子层(叫做第一电子层)上,一般用图3·6(り)来描述氢原子的结构.
按着原子核内质子数(亦就是核电荷数)递增的顺序,第3个元素是,它的原子核内有3个质子,核外相应也有3个电子,其中2个电子和前述的氦相似,它们的能量大致相同,在同一个电子层(第一电子层)上.另1个电子的能量较高,它在离核远的地方绕核运转,我们说这个电子是在第二电子层上.悝原子结构的示意图如图3·6()所示。
第4个元素做以及后面的第5、第6、第7第8、第9和第10个元素(哪、碳、氮、氧、氯和氖),就是它们原子核内分别有4个、5个、6个、7个、8个、9个和10个质子,核外相应也有同数的电子,它们都和锂相似,除其中2个电子的能量较低,是在第一电子层上外,其余电子的能量较高,都在第二电子层上.因此这些元素的原子的第二电子层上,分别有2~8个电子。
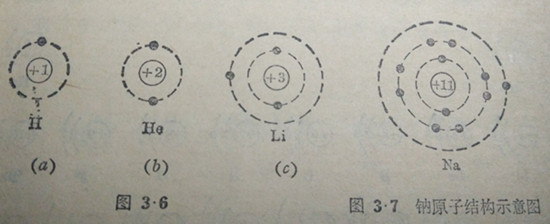
第11个元素是钠,原子核内有11个质子,核外相应有11个电子:其中2个电子的能量较低,在第一电子层上;另外8个电子能量较高,在第二电子层上;最后一个电子的能量更高,它在离核更远的地方运转.亦就是这个电子是在第三电子层上.钠原子结构的示意图如图3·7所示。
从第]2个元素镁,以下是铝、硅、磷、硫、氯到第18个元素,和前述的钠相似,它们都有3个电子层.第一电子层上有2个电子,第二电子层上有8个电子,第三电子层上有2个到8个电子。
从第19个元素钾开始,原子核外又有了一个新的电子层,即第四电子层由此可以看出,原子核外的电子是分成若干个电子层排布的.原子核外电子分层排布的理论,是丹麦科学家波尔首先提出来的,它相当成功地解释了许多实验事实。
从最简单元素氢到第19个元素钾,原子核外电子分层排布的情况,可以用图3·8来表示。
应该指出,原子核外电子的真实运动状况极其复杂,上面的这些示意图是大大简化了的,它只是表示了各个也子层上排布的电子数,以及它们能量的相对大小和运转范围离核的相对远近罢了。

在原子核外各电子层上最多可以容鈉电子的数目是有定限制的,它可以用一个公式2N2来表示,公式里的N代表电子层数.从这个公式可以算出,第一电子层(n=1)最多可以容纳2×1*2=2个电子;第二电子层(N=2)最多可以容纳2×2*2=8个电子;第三电子层(N=3)最多可以容2×3*2=18个电子,等等,但是,任何原子的最外电子层(不论它是第几层)上最多不能超过8个电子.
如果电子层上排布的电子数目日,已经达到了它可以容纳的最多电子数数,我们称它为饱和层;反之,如果还没有达到可以容纳的最多电子数,我们称它为不饱和层。
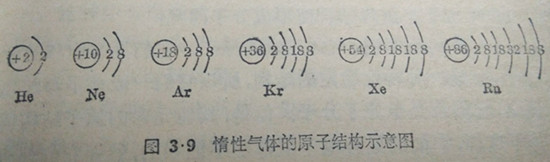
凡是最外电子层具有饱和层结构的元素,它们的化学质都非常稳定,一般不能参加任何化学反应.例如我们在第一册(§2·1)里讲过的惰性气体一一氢、氖、氩、氪、氙、氡等,它们的最外电子层都是饱和层.氦最外层(亦就是第一电子层)有2个电子,氖、氩、氪、氙、氡最外层都有8个电子图3·9。
如果最外电子层是不饱和层,这些元素的化学性质就比较活泼.通过多种多样的化学反应,相同的或者不相同的原子可以结合成各种不同的分子.关于这个问题,我们将在下一节里详细讨论。