1789年发现铀,直到1939年发现铀的裂变之前,铀的重要性并不突出,当时它的矿石作为镭的来源和少量用于制造有色玻璃和陶瓷。当铀作为核燃料后,铀就成为特别重要的原料。
铀在自然界主要存在于沥青铀矿,其主要成分为U3O8。提炼方法很多而且复杂,但最后步骤通常用萃取法将硝酸铀酰从水溶液中萃取到有机相,而得到较纯的铀化合物。
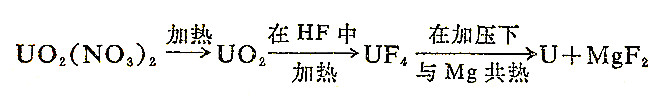
金属铀的制备方法是将UF4还原:
能发生裂变的同位素U-235(在天然铀中只占0.72%)与U-238(99.2%)的分离方法通常用UF6气体扩散法。U-235作为反应堆的核燃料。
新切开的铀具有银白色光泽,是密度最大的金属之一(19.07g·cm-3)。铀是一种很活泼的金属,与很多元素可以直接化合。在空气中表面很快变黄,接着变成黑色氧化膜,但此膜不能保护金属。粉末状铀在空气中可以自燃。铀易溶于盐酸和硝酸,但在硫酸、磷酸和氢氟酸中溶解较慢。它不与碱作用。

(1)氧化物
主要氧化物有UO2(暗棕色);U3O8(暗绿)和UO3(橙黄色)。
三氧化铀(UO3),可将硝酸铀酰(UO2(NO3)2)在600K分解得到UO3:
2UO2(NO3)2=2UO3+4NO2+O2
U3O8和UO2可以根据以下反应制得:
3UO3=(1000K)U3O8+1/2O2
UO3+CO=(623K)UO2+CO2
UO3具有两性,溶于酸生成铀氧基UO22+,溶于碱生成重铀酸根U2O72-。U3O8不溶于水,但溶于酸生成相应的UO22+的盐,UO2缓慢溶于盐酸和硫酸中,生成U(Ⅳ)盐,但硝酸容易把它氧化成UO2(NO3)2。
(2)硝酸铀酰(或硝酸铀氧基)
将铀的氧化物溶于硝酸,由溶液可析出柠檬黄色的六水合硝酸铀酰晶体(UO2(NO3)2·6H2O),它带黄绿色荧光,在潮湿空气中变潮。易溶于水、醇和醚、UO22+离子在溶液中水解,在298K时其水解产物为UO2OH+、(UO2)2(OH)22+和(UO2)3(OH)5+。UO22+离子的水解介于U3+和U4+之间,其中U4+水解得最历害,硝酸铀酰与碱金属硝酸盐生成MⅠNO3·UO2(NO3)2复盐。
(3)铀酸盐
在硝酸铀酰溶液中加碱,即析出黄色的重铀酸盐。例如,黄色的重铀酸钠(Na2U2O7·6H2O)。将此盐加热脱水,得无水盐,叫“铀黄”,应用在玻璃及陶瓷釉中作为宝贵的黄颜料。
(4)六氟化铀
铀的氟化物很多,有UF3、UF4、UF5、UF6,其中以UF6最重要。UF6可以从低价氟化物氟化而制得。它是无色晶体,熔点337K,在295K时的蒸气压为153kPa(115mm),在干燥空气中稳定,但遇水蒸气即水解:
UF6+2H2O=UO2F2+4HF
六氟化铀是具有挥发性的铀化合物,利用238UF6和235UF6蒸气扩散速度的差别,使U-235和U-238分离,而得到纯U-235核燃料。因此,UF6是最重要的铀的化合物。