























我们知道硫能跟氧气直接成二氧化硫和三氧化硫两种硫的氧化物.这两种硫都是酸性氧化物,它们是相应的含氧酸(亚硫酸和硫酸)的酐。
二氧化硫(亚硫酐)和亚硫酸,二氧化硫的分子式是SO2,它相应的水化物是亚硫酸,分子式是H2SO3.
1,二氧化硫的物理性质,二氧化硫是无色的气体,具有令人咳呛的特殊的刺激性气味.在家庭里,有时时为了於灭种细菌,在屋内熏烧硫黄时,就能闻到这种气味。
二氧化硫有毒,它对粘膜有强烈的刺激作用.因此,在有关二氧化硫的试验时,应该特别注意通风.
二氧化硫比空气重,和相同条件下同体积空气的重量比是2.2。
二氧化硫容易溶解于水,在通常情况下,1体积水大概能够溶解40体积的二氧化硫气体。
二氧化硫是最容易液化的气体之一,利用一般的致冷剂(冰和食盐的混和物),或者在平常温度下,把压强增加到3~5个大气压,就能把它冷凝成液体.液态二氧化硫的沸点是-10C.
2.二氧化硫的化学性质,二氧化硫是一种酸性氧化物,它具有酸性氧化物的一般通性.例如:
(1)能跟水反应生成相应的酸(亚硫酸)
S02+H20=H2S03
因此,二氧化硫又称亚硫酐.
(2)能跟碱性氧化物化合生成盐(亚硫酸盐),例如
SO2+Cao=Caso3
亚硫酸钙
(3)能能跟碱反应生成盐(亚硫酸盐)和水,例如
SO2+2NAOH=Na2SO3 +H2O
亚硫酸钠
二氧化硫除具有上述的一般酸性氧化物的通性以外,还具有它自己的特性:
(1)在二氧化硫分子里硫的化合价是4价,这还不是硫的最高化合价,因此,二氧化硫在一定条件下,还能眼更多的氧化合,二氧化硫在有催化剂(铂石棉①等)存在时,在适当的高温下能够被空气里的氧气氧化,生成三氧化硫,反应的化学方程式是:
2SO2+O2=(铂石棉)加热=2S03
(2)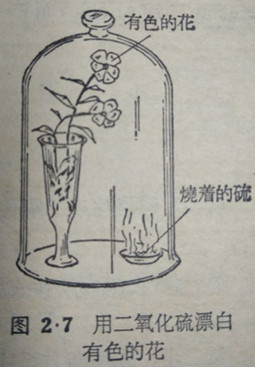 二氧化硫对某些有色的有机物质有漂白作用.如果在燃烧硫黄的玻璃钟罩里放置用水浸湿过的红色鲜花(图2·7),可以看到花的红色渐渐变淡.二氧化硫漂白物质的化学反应和上一章所讲的氯气的漂白作用完全不同.前面着讲过,氯气的漂白作用是由于氯气跟水反应后生成的次氯酸把色素氧化,变成无色物质.二氧化硫不能氧化色素,但它能和色素结合生成。
二氧化硫对某些有色的有机物质有漂白作用.如果在燃烧硫黄的玻璃钟罩里放置用水浸湿过的红色鲜花(图2·7),可以看到花的红色渐渐变淡.二氧化硫漂白物质的化学反应和上一章所讲的氯气的漂白作用完全不同.前面着讲过,氯气的漂白作用是由于氯气跟水反应后生成的次氯酸把色素氧化,变成无色物质.二氧化硫不能氧化色素,但它能和色素结合生成。
①销石棉就是表面上附有许多极细铂粉的石棉,把石棉在铂氯酸(H2PtC16)的稀溶液里浸透,然后把它放在火焰上灼烧,铂氯酸受热分解,生成很细很细的粉,附着在石棉的表面上,由于铂分散很细,因此它的表面积很大,催化作用比通的铂粉要强得多。
无产的化合物于这种无色化合数不是十分稳定的,经过种时它又重新分。因此,二化硫漂白的物质,
3.二氧化硫有着广泛的用途,二氧化硫后生成的三氧化硫,是制造最重要的化工产品——硫酸的原料.二氧化磁可用作杀灭许多微生物的药剂.推湿的谷念、下室、地溶、发丽等可用燃烧硫黄来熏杀霉菌,二氧化硫可以代氯气用来漂白毛、丝、草帽绠等,因为这些物质如果用气求漂自,它们的纤维容易受到伤害。
利用二氧化硫容易液化的性质,可以用于某种机械冷却器(例如电冰箱).先用歴气机增加压强,使二氧化硫气体液化,然后让它脈蒸发,液态二氧化碗在发时要吸收大量氧化硫主要是由燃烧空气的温度急剧下降。
4.在工业上硫或黄铁矿(FeS2)而产生的,反应的化学方程式是:
S+O2=-燃烧S02
4FeS2+1102=燃烧=2Fe2o3+8SO2
黄铁矿生成二氧化硫的化学方程式的平衡,可按按以下步骤进行:
第一步,把反应物和生成物的分子式分写在方程式的两边,即
Fes2+02——Fe2o2+S02
第二步,先平衡方程式两边的铁原子数,右边有2个铁原子,左只有1个铁原子,因此在左边分子式FeS2前面添一系数“2”,得
2FS2+02--FE203+So2
第四步,再平衡方程式两边的氧原子数,右边共有11个氧原子,左边只有2个氧原子,因此在左边分子式O2前面添一系数11/2得
2FES2+11/2 O2--FE2O3+4s02
第五步,把各物质的系数都乘以2,以消除O2前画的分数,并在方程式两边划上等号,并注明反应条件,得
4FES2+11O2=燃烧=2Fe2O3+8S02
在实验室里,二氧化硫通常用亚硫酸的分解反应来制取但是亚硫酸是一种极不稳定的酸,实验室里没有现成的亚硫酸,必须临时制备.因此,要制取二氧化硫,先要制得亚硫酸(象实验室里制取二氧化碳时先要制得碳酸一样).亚硫酸可以利用亚硫酸盐(通常用亚硫酸钠)眼酸(通常用硫酸或稀盐酸)的复分解反应制得,这个反应在常温下就能进行,例如:
Na2S03+H2S04=H2S03+Na2S04
亚硫酸钠 亚硫酸
生成的亚硫酸,立即分解生成二氧化硫和水:
H2SO3=H20+SO2
把这两个反应相加,总的反应是:
Na2S03+H2S04 =Na2S04+H2O+S02
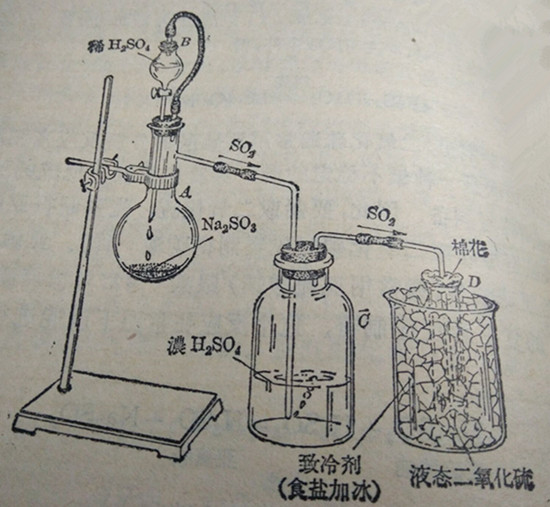
实验室里制二氧化硫的装置如图28所示,在蒸馏烧瓶(有支管的)A里放入亚硫酸粉末(亚硫酸钠是一种白色粉末),由分液漏斗B逐滴滴入稀硫酸,烧瓶里立即有二氧化硫气体产生,为了使生成的二氧化硫干燥,先把它通过盛有浓硫酸的C瓶(浓碗酸有强烈的吸收水蒸气的性质,因此能干燥气体),再把这デ的二氧化磁气体导入浸在致冷剂(Ww盐的混物)里的试D里.几分钟后,可以在试管头少量液态的二氧化硫,如果把试管取出,用手握住底由于受爱到手心的热,就立刻沸腾而的液态二氧化硫。
5.亚硫酸,二氧化硫溶解于水,眼水反应生成亚硫因为亚硫酸很不稳定,容易分解重新放出二氧化硫,因此,我们只能制得很稀的亚硫酸的水溶液(和第一册3·42335讲的碳酸一样)。
亚硫酸具有显著的酸性,它虽弱于盐酸、硫酸和硝酸等强酸但强于碳酸酸、氢硫酸、醋酸等弱酸,因此可以说它是一种中等度的酸。
亚硫酸具有酸的一般通性(参看第一册第五章55·4).例如:
Mg+H2SO3 =Mgso3+H2
亚硫酸镁
Cao+H2SO3=Caso3+H2O
亚硫酸钙
2NAOH+H2S03=Na2SO3+2H2O
亚硫酸钠
由于亚硫酸的不稳定性,它跟其他盐类的反应一般不易发生。
亚硫酸的特性是容易被氧化.把亚硫酸放在敵口容器里,慢慢地被空气里的氧气氧化而成硫酸:
2H2S03+O2=2H2S04
亚硫酸 硫酸
6.亚硫酸盐,亚硫酸是是二价酸,因此,它可以生成正盐,也可以生成酸式盐.例如,当亚硫酸跟过量的氢氧化钠反应时,生成正盐(Na2SO3);氢氧化钠用量不足时,生成酸式盐(NAHS03)
H2SO3 +2NAOH= Na2SO3+2H2O
亚硫酸钠
H2SO3+NAOH=NAHSO3+H2O
亚硫酸氢钠
过量的亚硫酸跟消石灰反应(或把二氧化硫气体通入氢氧化钙)2生成亚硫酸氢钙[Ca(HSO3)2]
2H2S03 +Ca(OH)2 =Ca(HSO3)2+2H20
亚硫酸 氢氧化钙 亚硫酸氢钙
亚硫酸氢钙能够溶解木材里的胶状物质(称做“木素”).因此在造纸工业上,用亚碗酸氢钙和切成小片的木材共煮,可得比较纯粹的纤维素。
亚硫酸钠和草酸(一种有机酸,它的分子式是H2C2O4,是一种白色结晶)的混和物在干燥时不起反应,遇水能缓慢地出二氧化硫,可以用来漂白草帽缏等。