硫化氢的化学性质
1.不稳定性硫化氢和相应的氧的氢化物一一水来比较,显得很不稳定,我们知道,水是一种相当稳定的化合物,只有加热到1000°C以上时,才开始分解:
2H2O=1000°C=2H2+O2
但硫化氢只要受热到300C以上时,就会分解成硫和氢气,
H2s=300C=H2+S
硫化氢不如水稳定这一实验事实,说明了硫的化学性质不如氧活泼.
2.跟氧的反应硫化氢是一种可以燃烧的气体,它在空气里燃烧时发出淡蓝色的火焰.如果空气的供给不充分,硫化氢不完全燃烧时生成水和硫,反应的化学方程式是:
2H2S+O2=不完全燃烧=2H20+2S
在硫化氢发生器的导管口处燃点硫化氢气体,管口即有徽弱的淡蓝色火焰,用一只冷的瓷皿,使皿底靠近硫化氢的火焰(图2·5),这样由于得不到究分的空气,硫化氢只能进行不完全燃燃,不久,皿底会心有黄色的硫的薄层。
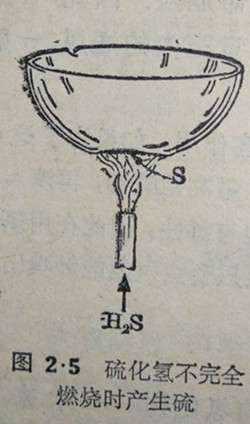 从上面的化学方程式可以看出,在这个反应里,单质的氧它置换了硫化氢分子里的硫,这也说明了氧的化学性质比硫活泼当硫化氢充分燃烧时,有二氧化硫气体产生:
从上面的化学方程式可以看出,在这个反应里,单质的氧它置换了硫化氢分子里的硫,这也说明了氧的化学性质比硫活泼当硫化氢充分燃烧时,有二氧化硫气体产生:
2H2S+3O2=完全燃烧=2H2O+2SO2
这很容易从二氧化硫气体的特殊刺激性气味辨认出来.如如果在硫化氢火焰燃烧时产生上方,悬置一张洁过水的蓝色石试纸,很快就会变成红色.这是因为硫化氢燃烧后产生的二氧化硫,跟试纸上的水反应后生成亚硫酸(HI2SO2)的缘故。
硫化氢的实验室制法在实验室里,硫化氢是由硫化亚铁(FeS,一种黑色质脆的固体)跟稀酸(稀盐酸或稀硫酸)发生复分解反应而产生的,反应的化学方程式是:
Fes+H2S04=Feso4+H2S
FeS+2HCl=FeCl2+H2S
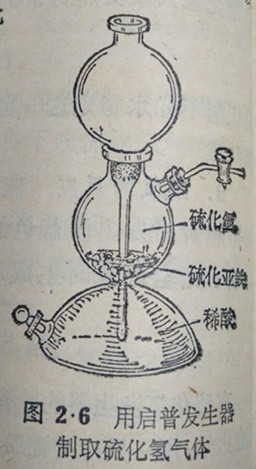
这个反应所用的试剂,一种是固体的碎块(硫化亚铁),另一种是液体(稀酸),反应时又不需要加热,因此,可以用启普发生器来制取硫化
氢气体(图2·6)。
 氢硫酸和氢硫酸盐(硫化物)硫化氢的水溶液呈酸性,能使蓝色的石试纸变,它是一种无氧酸,按照无氧酸的命名原则,它应该叫做氢硫酸。
氢硫酸和氢硫酸盐(硫化物)硫化氢的水溶液呈酸性,能使蓝色的石试纸变,它是一种无氧酸,按照无氧酸的命名原则,它应该叫做氢硫酸。
氢硫酸是一种酸,酸性要比前一拿里讲到的氢氯酸(杜酸)弱得多,例例如金属镁能跟氢硫酸发生置换反应放出氢气:
Mg+H2S=Mgs+H2
但这个反应比起铁跟盐酸的反应来要侵得多.
氢硫酸具有酸的一切通性,它能够跟各种碱性气化物、类和盐类发生反应生成氢硫酸的盐(即硫化物).例如:
PLO+H2s=pbs+H2O
硫化铝
(黑色)
2Naoh+H2S=Na2S+2H2O
硫化钠
(溶解于水)
Cd(NO3)2+H2S=Cds+2HNO3
硫化镉
(黄色)
上面这些反应里生成的硫化铅、硫化钠、硫化等都是氢硫酸的盐,称做金属硫化物.
各种不同的金属硫化物具有不同的溶解性:只有少数金属硫化物能够溶解于水;大多数金属硫化物都不溶于水.但其中有一部分能够溶解于稀盐酸中,另一部分则在稀盐酸中也不溶解:
各种不溶性的金属硫化物常显现出不同的颜色
表2·1列出了一些金属硫化物的溶解性和颜色
根据氢硫酸跟某种盐在溶液中反应后生成的金属硫化物的溶解性和颜色,可以初步判断出它是那一种金属的盐.例如,在某种盐溶液里加入氢硫酸的水溶液(或通入硫化氢),如果生成黄色沉淀,就可断定这种盐是镉盐;如果生成黑色沉淀,加入稀盐酸酸,这种种黑色沉淀仍不溶解,那末它可能是铅盐或者绸盐或者汞盐;如果没有沉淀生成,那应该是钠盐或钾盐.